Enzims i inhibidors
<<ENZIMS:<<
R: Estat de transició: poden tornar o acabar acció.
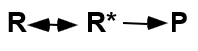 Energia activació: fa que s’arribi a l’estat de transició.
Energia activació: fa que s’arribi a l’estat de transició.
El catalitzador queda intacte després de la recció, redueix la quantitat d’energia i són específics.
<<Biocatalitzadors:<<
Tipus:
- ^^Enzims^^: proteïnes que intervenen en reaccions químiques immediates.
- ^^Vitamines^^: diverses estructures, s’incorporen a la dieta, reaccions químiques immediates com cofactors.
- ^^Hormones^^: diverses estructures que sintetitzen accions a distància.
Els enzims augmenten la velocitat de la reacció.
Reaccions químiques:
- Exergòniques: desprenen ATP, catabòlic
- Endergòniques: necessiten ATP, ANABÒLICA
Sintetitzar ATP:
-Nivell de substrats: fosfats al medi
-Fosforilació oxidativa
-Fotofosforilació
<<Enzims:<<
Estructura globular, més gran que el substrat.
Tipus d’enzims:
- ^^Globulars^^ ^^solubles^^: es troben al medi aquós
- ^^De^^ ^^membrana^^: origen bacterià
Actuen a molt baixa concentració:

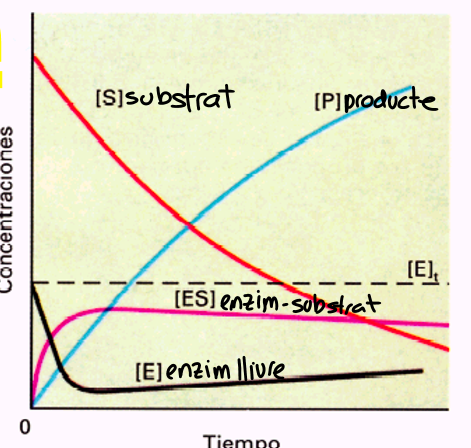
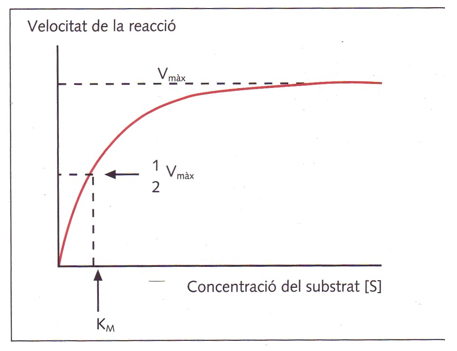
<<Cinètica enzimàtica:<<
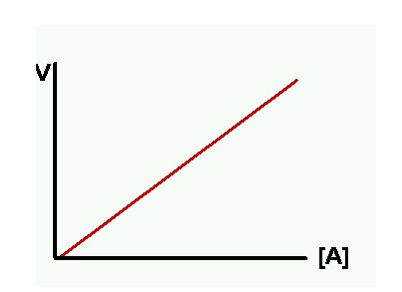
R.Q. no catalitzada: la velocitat augmenta proporcional a l’augment de concentració
R.Q. catalitzada: concentració d’enzim constant, la velocitat augmenta fina a saturar
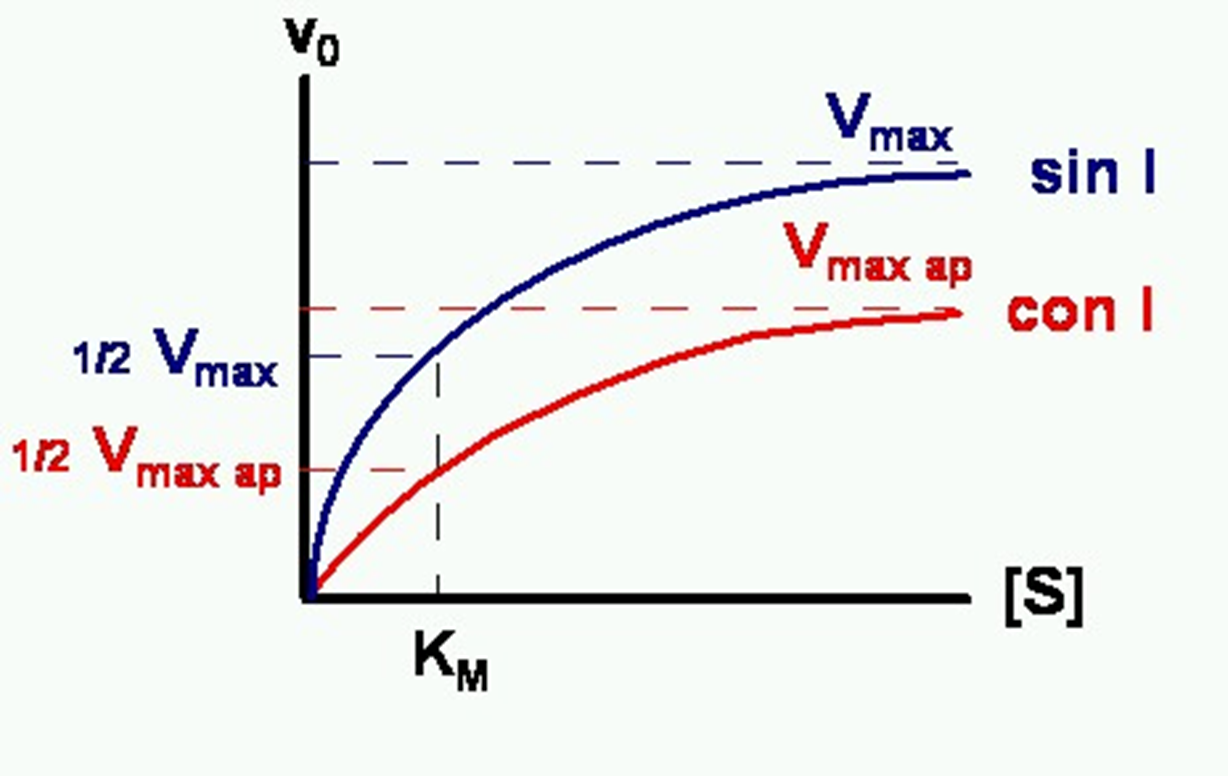
Km: concentració de substrat on la velocitat es la meitat, indica l’afinitat enzim-substrat.
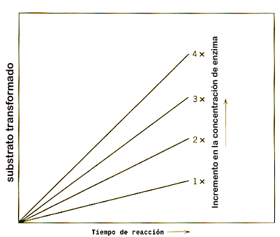
Substrat constant, augment enzim:
Factors que modifiquen l’activitat enzimàtica:
- Temperatura
- Ph, afecta al centre actiu.
<<Cofactors:<<
Enzim amb part proteica i cofactor.
Són necessaris s’acostumen a ingerir a la dieta.
- Inorgànics: Zinc, Coure
- Orgànics: ATP,ADP,FAD…
Els cofactors inorgànics poden estar sempre associats a la proteïna, grup prostètic.
<<Estructura:<<
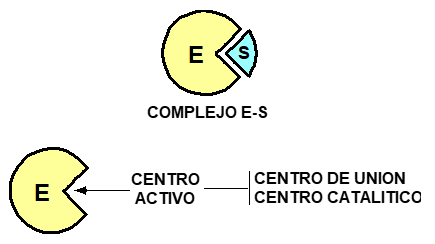
^^Aminoàcids conformacionals^^: donen forma
Centre actiu:
- ^^Aminoàcids de contacte^^: participen en la unió del substrat però no en la reacció
- ^^Aminoàcids catalitzadors^^: participen en la recció
<<Mecanismes d’unió:<<
^^Model clau-pany^^: la forma de l’enzim no canvia:
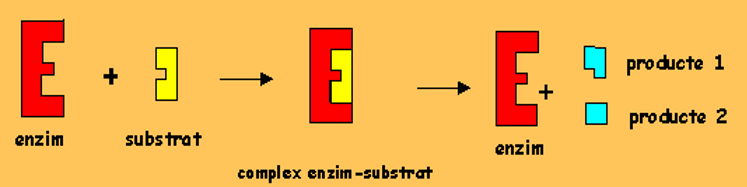
^^Model acoblament induït^^: la forma canvia quan està en contacte amb el substrat.
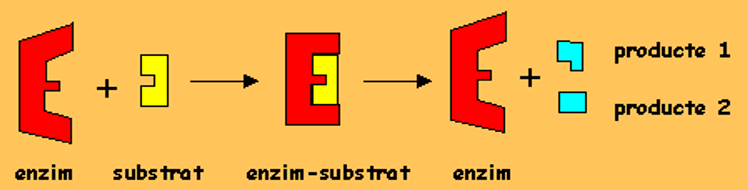
]]INHIBIDORS:]]
Fan disminuir activitat enzimàtica perquè entren en contacte amb el centre actiu però no afecten a la forma.
- Isostèrics: la seva funció es fa al centre actiu
- Al·lostèrics: entra en contacte amb el centre al·lostèric
- Tius d’inhibicions:
- Irreversible: proboca molts danys irrebersibles.
- Reversoble: només perjudica quan estan enllaçats.
- Competitiva: inhibidor semblant al substrat i competeixen per l’enzim
- No competitiva: inhibidor i el substrat no s’asemblen, nos’uneixen al mateix lloc i el perjudica.
]]Reversible competitiva:]] 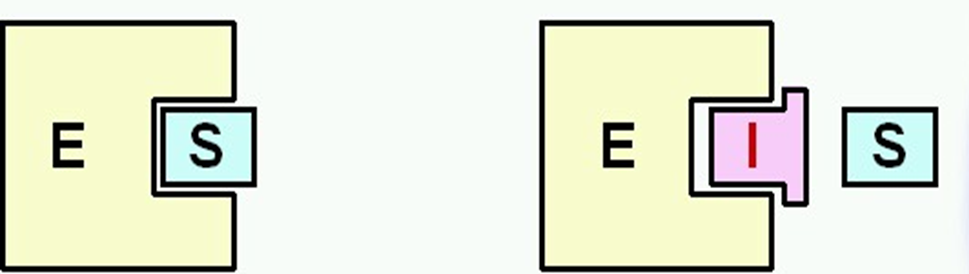
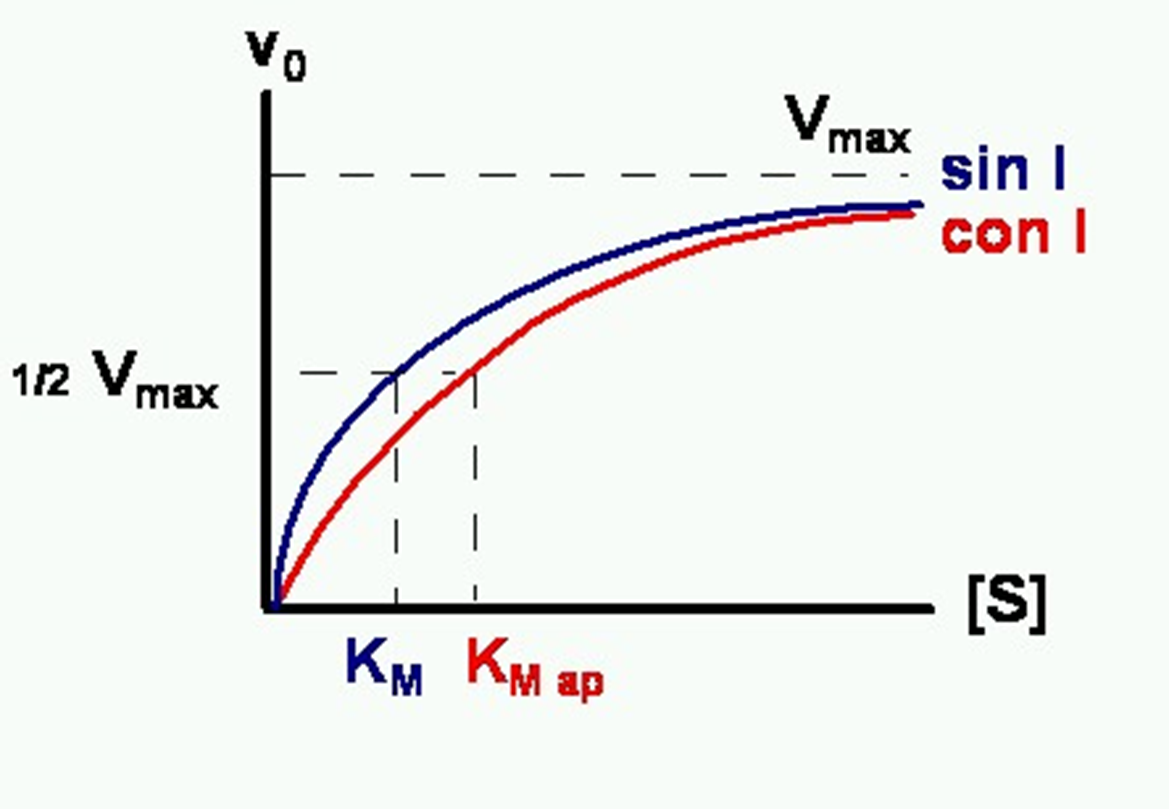
Provoquen que a la gràfica la Km sigui més gran però que assoleixi la velocitat
màxima.
]]Reversible no competitiva:]]
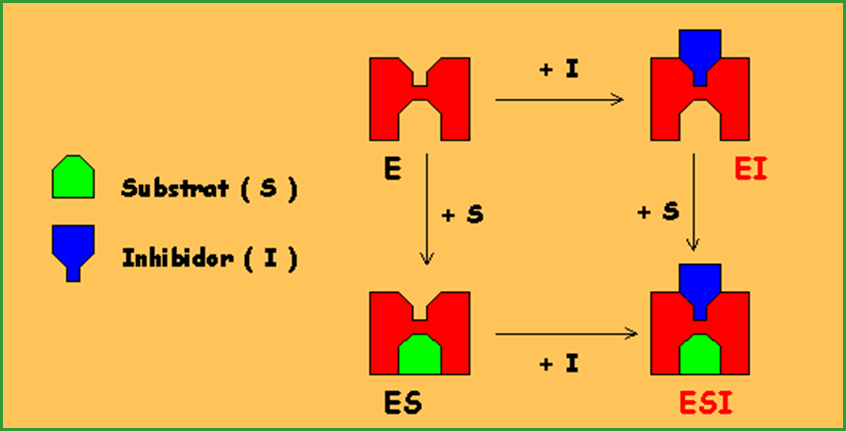
La Km és igual però la velocitat màxima es redueix.