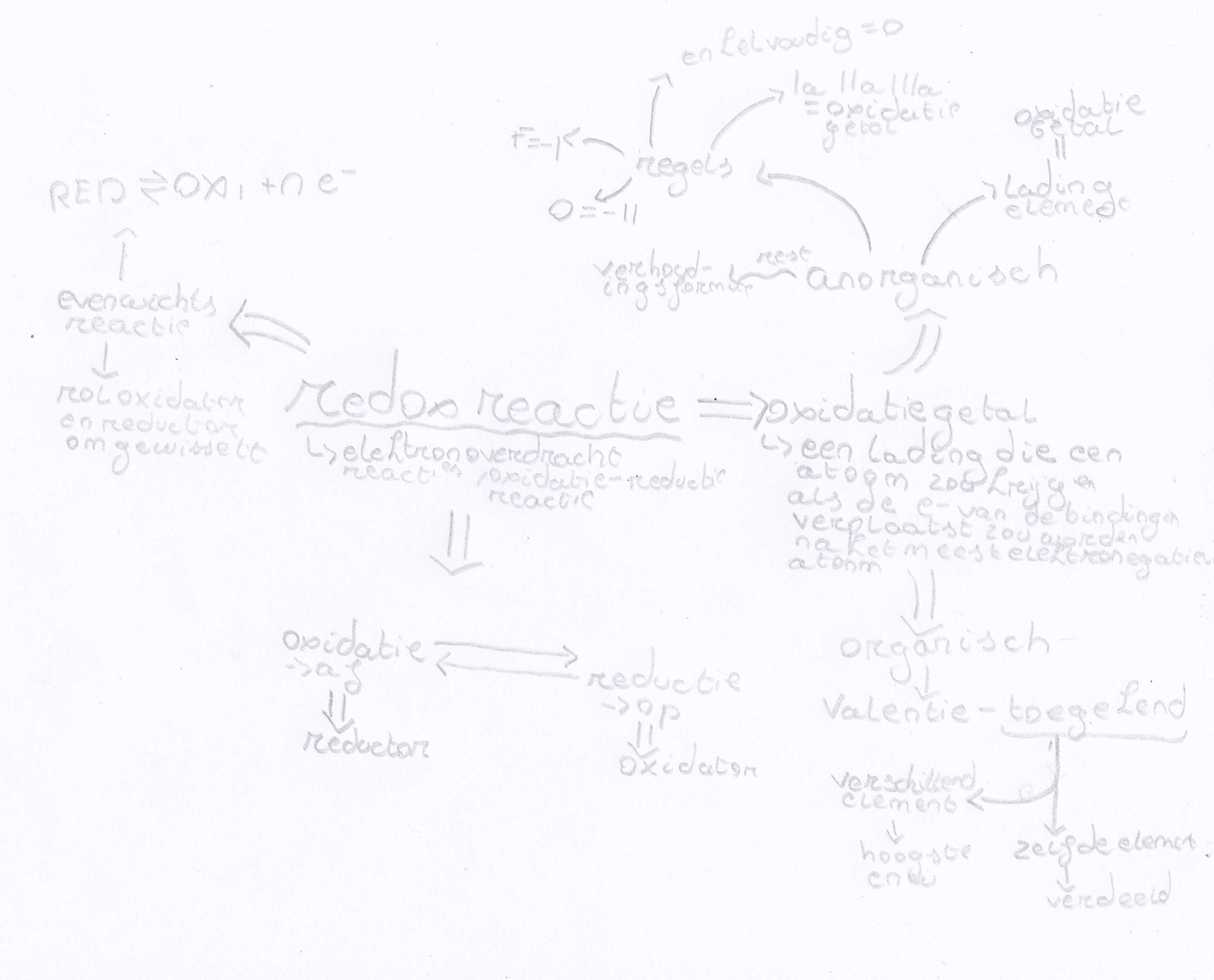
oxidatiegetal
lading die het atoom zou krijgen als de e- van de bindingen verplaats zouden worden na het meest elektronegatieve atoom.
anorganisch
in een ionbinding, dus een binding tussen metaal en niet metaal elementen. Bij deze binding worden electronen overgedragen en krijgt elk element een lading, die lading is gelijk aan de oxidatiegetal.
regels
De groepen Ia, IIa en IIIa zijn hetzlfde als de oxidaitegetall. Enkelvoudige atomen hun oxidatiegetal = 0, O = -2, F = -1. Voor de rest doe je de verhoudingsformule.
organisch
Valentie elektronen - Toegekende electronen = OxidatieGetall
Redoxreacties
elektronoverdrachtsreacties, oxidatie-reductie reactie
Als een oxidatie optreedt, geef je elektronen af en noem je het een reductor. Reductie is als je elektronen opneemt en dan noem je dat een oxidator
Redoxreacties zijn evenwichstreacties, dus de reactie is omkeerbaar. Een oxidator wordt een reductor en omgekeerd. Dit noem je een redoxkoppel en er zij er 2 per reactie
RED <=> OX + N e-