
1_.Atome biophysique
Introduction à l'atomistique
Discipline développée au 20ème siècle
Passage du stade philosophique à la physique et à la chimie
La matière est constituée de molécules formées d'atomes liés entre eux
Définition de l'atome
Constituant élémentaire de la matière
Découverte de sa constitution grâce aux progrès en physique théorique et expérimentale
Structure générale de l'atome
État fondamental de l'atome est stable et électriquement neutre
Noyau central dense et petit
Nuage électronique avec des électrons en mouvement autour du noyau
Le noyau atomique
Rayon d'un noyau mesure environ 10^-15 à 10^-7 m
Constitué de deux types de particules : protons et neutrons (nucléons)
Le nombre de nucléons est noté A
Le proton
Particule nucléaire stable
Charge positive q = +1,6 x 10^-19 Coulombs
Masse mp = 1,67 x 10^-27 Kg
Le nombre de protons est noté Z
Le neutron
Particule avec charge nulle
Masse mn = 1,68 x 10^-27 Kg
Le nombre de neutrons est noté N
Exprimées en unité de masse atomique (u.m.a) ou en électron volt (eV)
1 u.m.a = 1/12 de la masse de l'atome de carbone = 1,66 x 10^-27 Kg
1 u.m.a = 931 x 10^6 eV = 931 MeV
Tableau des conversions des particules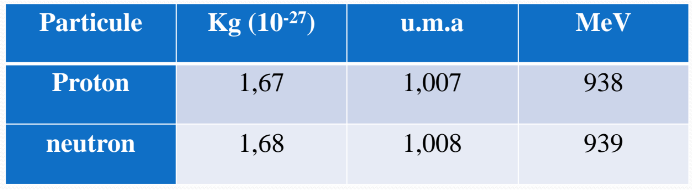
Proton : masse = 1,67 u.m.a, masse = 938 MeV
Neutron : masse = 1,68 u.m.a, masse = 939 MeV
Stabilité du noyau
Les noyaux de faible poids atomique suivent la bissectrice
Le nuage des atomes dévie du côté de prédominance neutronique (N > Z) mais reste stable
Forces nucléaires
Existence de nucléons en nombres différents, chargés ou de charge nulle
Plusieurs forces en jeu : forces coulombiennes répulsives, forces nucléaires attractives
Forces répulsives
Forces coulombiennes répulsives entre les protons positifs du noyau
Grand rayon d'action
Interaction Proton - Proton (P-P)
Forces attractives
Forces nucléaires attractives entre un nucléon et les autres nucléons dans son voisinage immédiat (P-N, N-N)
Forces nucléaires
Les forces nucléaires attractives sont plus intenses que les forces répulsives
Assurent la cohésion et la stabilité du noyau
Défaut de masse
E = Δm . c²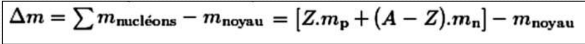
Défaut de masse
Énergie de liaison nucléaire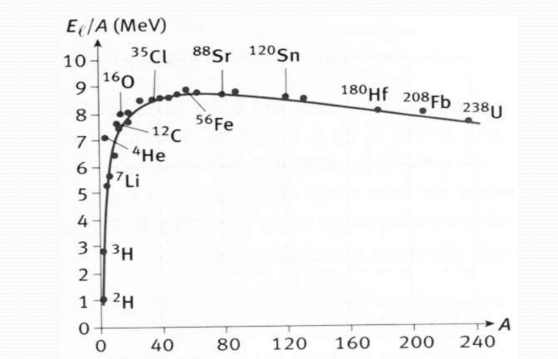
Nombres magiques
Nombres de protons ou de neutrons pour lesquels un noyau atomique est particulièrement stable
Les sept nombres magiques vérifiés expérimentalement sont : 2, 8, 20, 28, 50, 82, 126
Modèle nucléaire en goutte liquide
Les nucléons gardent leurs propriétés
Explique la fission nucléaire et les émissions de particules à partir du noyau
Modèle nucléaire en couche
Les nucléons sont disposés sur des niveaux d'énergie
Explique l'émission de rayonnement électromagnétique du noyau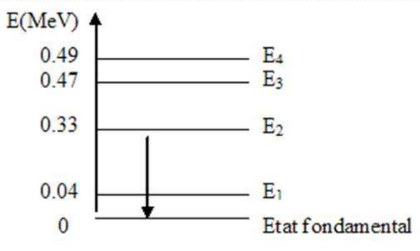
Électron périphérique
Particule stable avec charge négative q = -1,6 x 10^-19 Cb et masse me = 9,11 x 10^-31 Kg
Électroneutralité assurée par l'égalité du nombre de protons du noyau et d'électrons périphériques
Exemple : l'atome d'oxygène a 8 protons, 8 neutrons et 8 électrons
Énergie de liaison (électron)
Les électrons gravitent autour du noyau à des distances finies
Restent liés à leur trajectoire grâce à une énergie de liaison
Les électrons les plus liés à l'atome sont les plus proches du noyau
Plus on s'éloigne, plus l'énergie de liaison est faible et il est facilement arraché à l'édifice atomique
E = -b0 / n^2 avec b0 = 13,6 eV
Les modèles atomiques
Thomson (1887) : l'atome est un cake au raisin avec des électrons éparpillés dans une matière positive
Rutherford (1911) : modèle du système solaire avec un noyau central et des électrons en orbite
Bohr (1913) : modèle à niveaux d'énergie fixes, repris par Einstein avec le modèle quantique
Schrödinger : modèle où l'électron se trouve dans un nuage (orbitale)
Nomenclature des atomes
Représentés par A (nombre de masse) et Z (nombre de charge ou numéro atomique)
N = A - Z (nombre de neutrons)
Exemple de nomenclature : 27 13Al a 14 neutrons (N = 27 - 13)
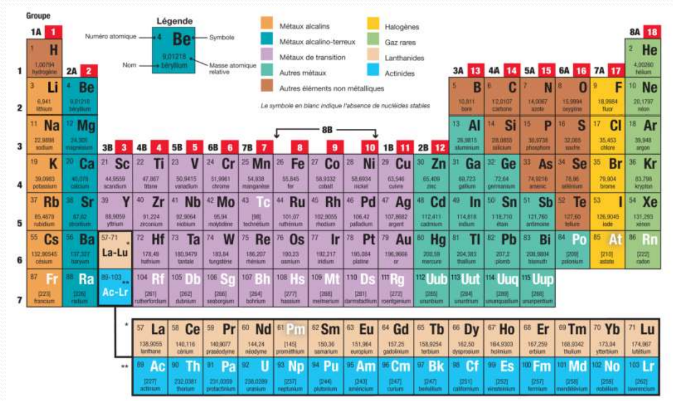
Le tableau de Mendeleïev est un tableau périodique des éléments chimiques.
Il classe les éléments en fonction de leur numéro atomique et de leurs propriétés chimiques.
Le tableau de Mendeleïev est utilisé pour organiser et prédire les propriétés des éléments.
Les isotopes sont des atomes ayant le même nombre de protons (même numéro atomique Z) mais un nombre de neutrons différent.
Les isotopes ont des propriétés chimiques similaires en raison de leur même nombre de protons.
Les isotopes peuvent avoir des masses atomiques différentes en raison de leur nombre de neutrons différent.
Les isotones sont des atomes ayant le même nombre de neutrons (même N).
Les isotones ont des propriétés chimiques différentes en raison de leur nombre de protons différent.
Les isotones peuvent avoir des masses atomiques différentes en raison de leur nombre de protons différent.
Les isobares sont des atomes ayant le même nombre de nucléons (même A).
Les isobares ont des propriétés chimiques différentes en raison de leur nombre de protons et de neutrons différent.
Les isobares ont des masses atomiques différentes en raison de leur nombre de protons et de neutrons différent.
Les isomères sont des atomes ayant le même nombre de protons (même Z), le même nombre de neutrons (même N) et le même nombre de nucléons (même A), mais ils diffèrent par leur énergie.
Les isomères peuvent exister sous différentes formes énergétiques, ce qui peut affecter leurs propriétés chimiques et leur stabilité.
Les connaissances acquises grâce à l'étude de l'atome ont permis de développer un grand nombre de sciences.
Les sciences médicales, telles que la biochimie, la médecine nucléaire et la radiologie, ont bénéficié des avancées dans la compréhension de l'atome.
L'étude de l'atome a contribué à améliorer les diagnostics médicaux
Introduction à l'atomistique
Discipline développée au 20ème siècle
Passage du stade philosophique à la physique et à la chimie
La matière est constituée de molécules formées d'atomes liés entre eux
Définition de l'atome
Constituant élémentaire de la matière
Découverte de sa constitution grâce aux progrès en physique théorique et expérimentale
Structure générale de l'atome
État fondamental de l'atome est stable et électriquement neutre
Noyau central dense et petit
Nuage électronique avec des électrons en mouvement autour du noyau
Le noyau atomique
Rayon d'un noyau mesure environ 10^-15 à 10^-7 m
Constitué de deux types de particules : protons et neutrons (nucléons)
Le nombre de nucléons est noté A
Le proton
Particule nucléaire stable
Charge positive q = +1,6 x 10^-19 Coulombs
Masse mp = 1,67 x 10^-27 Kg
Le nombre de protons est noté Z
Le neutron
Particule avec charge nulle
Masse mn = 1,68 x 10^-27 Kg
Le nombre de neutrons est noté N
Exprimées en unité de masse atomique (u.m.a) ou en électron volt (eV)
1 u.m.a = 1/12 de la masse de l'atome de carbone = 1,66 x 10^-27 Kg
1 u.m.a = 931 x 10^6 eV = 931 MeV
Tableau des conversions des particules
Proton : masse = 1,67 u.m.a, masse = 938 MeV
Neutron : masse = 1,68 u.m.a, masse = 939 MeV
Stabilité du noyau
Les noyaux de faible poids atomique suivent la bissectrice
Le nuage des atomes dévie du côté de prédominance neutronique (N > Z) mais reste stable
Forces nucléaires
Existence de nucléons en nombres différents, chargés ou de charge nulle
Plusieurs forces en jeu : forces coulombiennes répulsives, forces nucléaires attractives
Forces répulsives
Forces coulombiennes répulsives entre les protons positifs du noyau
Grand rayon d'action
Interaction Proton - Proton (P-P)
Forces attractives
Forces nucléaires attractives entre un nucléon et les autres nucléons dans son voisinage immédiat (P-N, N-N)
Forces nucléaires
Les forces nucléaires attractives sont plus intenses que les forces répulsives
Assurent la cohésion et la stabilité du noyau
Défaut de masse
E = Δm . c²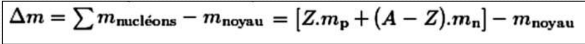
Défaut de masse
Énergie de liaison nucléaire
Nombres magiques
Nombres de protons ou de neutrons pour lesquels un noyau atomique est particulièrement stable
Les sept nombres magiques vérifiés expérimentalement sont : 2, 8, 20, 28, 50, 82, 126
Modèle nucléaire en goutte liquide
Les nucléons gardent leurs propriétés
Explique la fission nucléaire et les émissions de particules à partir du noyau
Modèle nucléaire en couche
Les nucléons sont disposés sur des niveaux d'énergie
Explique l'émission de rayonnement électromagnétique du noyau
Électron périphérique
Particule stable avec charge négative q = -1,6 x 10^-19 Cb et masse me = 9,11 x 10^-31 Kg
Électroneutralité assurée par l'égalité du nombre de protons du noyau et d'électrons périphériques
Exemple : l'atome d'oxygène a 8 protons, 8 neutrons et 8 électrons
Énergie de liaison (électron)
Les électrons gravitent autour du noyau à des distances finies
Restent liés à leur trajectoire grâce à une énergie de liaison
Les électrons les plus liés à l'atome sont les plus proches du noyau
Plus on s'éloigne, plus l'énergie de liaison est faible et il est facilement arraché à l'édifice atomique
E = -b0 / n^2 avec b0 = 13,6 eV
Les modèles atomiques
Thomson (1887) : l'atome est un cake au raisin avec des électrons éparpillés dans une matière positive
Rutherford (1911) : modèle du système solaire avec un noyau central et des électrons en orbite
Bohr (1913) : modèle à niveaux d'énergie fixes, repris par Einstein avec le modèle quantique
Schrödinger : modèle où l'électron se trouve dans un nuage (orbitale)
Nomenclature des atomes
Représentés par A (nombre de masse) et Z (nombre de charge ou numéro atomique)
N = A - Z (nombre de neutrons)
Exemple de nomenclature : 27 13Al a 14 neutrons (N = 27 - 13)

Le tableau de Mendeleïev est un tableau périodique des éléments chimiques.
Il classe les éléments en fonction de leur numéro atomique et de leurs propriétés chimiques.
Le tableau de Mendeleïev est utilisé pour organiser et prédire les propriétés des éléments.
Les isotopes sont des atomes ayant le même nombre de protons (même numéro atomique Z) mais un nombre de neutrons différent.
Les isotopes ont des propriétés chimiques similaires en raison de leur même nombre de protons.
Les isotopes peuvent avoir des masses atomiques différentes en raison de leur nombre de neutrons différent.
Les isotones sont des atomes ayant le même nombre de neutrons (même N).
Les isotones ont des propriétés chimiques différentes en raison de leur nombre de protons différent.
Les isotones peuvent avoir des masses atomiques différentes en raison de leur nombre de protons différent.
Les isobares sont des atomes ayant le même nombre de nucléons (même A).
Les isobares ont des propriétés chimiques différentes en raison de leur nombre de protons et de neutrons différent.
Les isobares ont des masses atomiques différentes en raison de leur nombre de protons et de neutrons différent.
Les isomères sont des atomes ayant le même nombre de protons (même Z), le même nombre de neutrons (même N) et le même nombre de nucléons (même A), mais ils diffèrent par leur énergie.
Les isomères peuvent exister sous différentes formes énergétiques, ce qui peut affecter leurs propriétés chimiques et leur stabilité.
Les connaissances acquises grâce à l'étude de l'atome ont permis de développer un grand nombre de sciences.
Les sciences médicales, telles que la biochimie, la médecine nucléaire et la radiologie, ont bénéficié des avancées dans la compréhension de l'atome.
L'étude de l'atome a contribué à améliorer les diagnostics médicaux