Grade 9 Science Exam
UNIT 1 - ÉCOLOGIE
ÉCOSYSTÈMES DURABLES
Définition: Un écosystème est un ensemble des organismes vivants et de leurs environnement physique et chimique.
Compsés de:
Les facteurs biotiques (vivants)
Les facteurs abiotiques (non-vivants)
Ces deux facteurs travaillent ensemble pour maintenir la durabilité des écosystèmes.
Cependant, la plupart des écosystèmes terrestres et aquatiques sont perturbés par des activités humaines intenses (EX. la construction et la production de la plastique) qui leur ____ non durables.
DURABILITÉ D’ÉCOSYSTÈME
La durabilité d’un écosystème est la capacité à maintenir l’équilibre écologique.
La plupart des écosystèmes naturels sont durable.
Un Équilibre Écologique: C’est l’équilibre naturel qui se réalise entre les êtres vivants et leur milieu en particulier au sein d’une chaîne alimentaire.
Dans un écosystème, IL Y A…
Une population comporte tous en individus d’une même espèce qui y vivant
Une communauté est formée de tous en organismes vivants dans un même écosystème
LES TRANSFERTS D’ÉNERGIE DANS LES ÉCOSYSTÈMES
La source primaire de l’énergie est le soleil.
Plusieurs organismes sont capables de transformer l’énergie lumineuse en énergie chimique grâce au processus de photosynthèse.
Le photosynthèse est un processus par lequel l’énergie du soleil est transformé en énergie chimique.
Les organismes photosynthétiques produisent leurs propres composés nutritifs riches en énergie à partir de l’énergie lumineuse un organisme sont appelés «Les Producteurs».
LE PRODUCTEUR
C’est un organisme qui produit sa propre nourriture riches en énergies à partir de l’énergie du soleil.
La plupart des producteurs utilisent d’énergie lumineuse pour transformer deux composés chimiques pauvres en énergie (le dioxyde de carbone et l’eau) en composés riches en énergie (sucre).
Ce faisant, ils libèrent d’oxygène dans l’environnement.
La réaction de la photosynthèse est représentée par l’équation suivante:
Énergie Lumineuse
Dioxyde de carbone + l’eau = Sucre + oxygène
LA RESPIRATION CELLULAIRE
C’est un processus par lequel le sucre et l’oxygène sont transformés en dioxyde de carbone et en eau par transmettre leur énergie aux cellules.
Son équation
Sucre + oxygène = Dioxyde de carbone + l’eau
D’où: La photosynthèse et la respiration cellulaire sont deux processus complémentaires (réciproques)
Plusieurs organismes ne peuvent effectuer de photosynthèse. Donc, il leur est impossible de produire leurs propres sucres riches en énergie ou leur matériaux de base. Ces organismes, appelés CONSOMMATEURS, doivent consommer d’autres organismes pour obtenir l’énergie.
CHAÎNE ALIMENTAIRE ET LE RÉSEAU ALIMENTAIRE
Def: Une chaîne alimentaire est série d’organisme qui se nourrissent chacun de suivant montrant le transfert d’énergie d’une organismes à l’autre.
On peut aussi dire chaîne alimentaire représent les RELATIONS TROPHIQUES entre différents organismes vivants (RELATIONS ALIMENTAIRES).
Habituellement, les chaînes alimentaires commencent par plante ou végétaux. Ensuite, on retrouve un être vivant herbivore qui se nourrit de la plante de départ, ensuite, on retrouve des animaux se nourrissent sur d’autres animaux qui les précèdent.
NIVEAU TROPHIQUE
Un niveau trophique est le niveau occupé par un organisme dans un écosystème d’après sa position dans la chaîne alimentaire.
5è Niveau trophique: Consommateurs tertiaires
4è Niveau trophique: Consommateurs secondaires
3è Niveau trophique: Consommateurs primaires
2è Niveau trophique: Producteurs
1er Niveau trophique: Décomposeurs
LES INFLUENCES BIOTIQUES ET ABIOTIQUES SUR LES ÉCOSYSTÈMES
Dans un écosystème, les facteurs tant biotiques qu‘abiotiques déterminent l’endroit où peut vivre une espèce.
FACTEUR LIMITANT
C’est tout facteur qui diminue la taille d’une population c‘est-à-dire freinent la croissance de la population.
CONSÉQUENCES DES FACTEURS LIMITES
Diminuer le nombre de naissance
Augmenter le nombre de décès
Favoriser l’émigration
Diminuer l’immigration d’une population
INFLUENCES DES FACTEURS BIOTIQUES
Les ressources alimentaire
Les relations trophiques
On distingue deux catégories de facteurs biotiques qui sont déterminés par les types d’interaction entre êtres vivants.
Les relations intraspécifiques
Les relations interspécifiques
LES RELATIONS INTRASPÉCIFIQUES
Ce sont les relations qu’ont individus au sein d’une même espèce comme la compétition, la coopération et la reproduction.
LES RELATIONS INTERSPÉCIFIQUES
Ce sont les relation qu’ont les individus entre deux ou plusieurs espèces différents. Ces relations peuvent être positives, neutres ou négatives pour les organismes. On distingue plusieurs types de relations interspécifiques.
La compétition: Entre individus en concurrence même ressource.
La prédation: Un individus se nourrit d‘un autre.
La mutualisation: Deux individus profitent mutuellement l‘un de l‘autre.
Le parasitisme: Un individu vit aux dépens d‘un organisme hâte et s‘en nourrit.
Le commensalisme: Un individus profite de l‘interaction sans profiter ni nuir à l‘autre.
UNIT 2 - CHIMIE
Les Éléments - Les Atomes et les Composés
A.La matière et ses propriétés
La chimie est la science qui étudie la nature de la matière et les changement qu’elle subit au cours de divers processus.
Définition: La matière
La matière constitue tout ce qui possède une masse et qui occupe l’espace. Outre la matière, noter que l’univers est composé d’énergie (lumière, chaleur, électrcité, etc…). C’est l’énergie qui cause le changement que subit matière.
La matière peut exister sous trois états physiques différents qui sont:
L’état solide (qui possède un volume et une forme fixe.)
L’état liquide (qui possède un volume défini mais aucune forme précise, il prend la forme de son contenant.)
L’état gazeux (qui n’a ni volume, ni forme définis, il prend le volume et la forme de son contenant.)
Propriétés de la matière
On distingue deux types des propriétés: Les propriétés physique et les propriétés chimiques
Propriétés physiques
Les propriétés physiques décrivent les caractéristiques physiques qui sont propres à une substance et qui peuvent être observées sans changer sa nature. Elles peuvent être qualitatives ou quantitatives.
Les propriétés physiques qualitatives ne sont pas mesurables et incluent la dureté, la malléabilité et la conductivité électrique.
EX: la couleur de ton cellulaire
Les propriétés physiques quantitatives sont mesurables, incluant la température, la hauteur et la masse.
EX: le poids de ton cellulaire
Les Changements Physiques
Un changement physique est un changement dans lequel la composition d’une substance n’est pas modifiée et où aucune nouvelle substance n’est introduite.
EX: Un fil de fer, tu le plies, il subit un changement physique, mais pas de composition.
Les Propriétés Chimiques
Une propriété chimique est une caractéristiques d’une substance déterminée par un changement de sa composition et la production d’une ou plusieurs nouvelles substances.
Changement Chimique
C’est un changement dans la composition de la ou des substances initiales et productions d’une ou de nouvelles substances.
EX: la pâte de farine devient la pizza durant un changement chimique qui est la cuisson au four.
Les manifestations d’un changement chimiques comportent:
Un changement de couleur
Un changement d’odeur
La production de gaz
La formation d’un précipité
Un changement de température
etc.
Qu’est-ce qu’un élément
Un élément est une substance formée d’une seule sorte d’atome. Il est impossible de séparer d’atomes ce type de substance par moyens physiques ou chimiques.
EX: Argent est un élément chimique plus simple
Tout élément chimique est représenté dans un tableau périodique par un symbole.
EX: Argent = Ag
Un élément peut donc être un atome qui est seul ou bien une molécule composée d’atomes identiques liés chimiquement ensemble.
EX: Fe, O2, H2
Qu’est-ce qu’une atome
Une atome est une particule très petite qui est à la base de la constitution de la matière, il est invisible à l’oeil nu et est indivisible.
Sa structure électrique
Un atome est constitué d’un noyau porteur d’électricité positive, on les appelle les protons (p+) et le porteur d’électricité négative, on les appelle les électrons (e-).
Dans une atome, il y a toujours autant de protons que d’électrons (#p+ = #e-).
L’ensemble constitué par le noyau et en électrons et en électrons est électriquement NEUTRE. Le noyau est très petit vis-à-vis de la taille de l’atome. Néamoins, sa poids constitue la quasi-totalité de celle de l’atome.
Qu’est-ce qu’un composé
Un composé formé lorsque des atomes différents se combinent ou encore sont liés chimiquement.
EX: H2O (l’hydrogène et l’oxygène sont combinées dans une proportion fixe de 2:1 pour former le composé de l’eau)
CO2 (le dioxyde de carbone, le carbone et l’oxygène sont combinées dans une proportion de 1:2)
Donc, dans un composé, les éléments sont chimiquement combinés en une proportion fixe.
Un composé est une molécule constituée d’atomes différents liés chimiquement ensemble.
Ces atomes différents peuvent être séparés par moyens chimiques.
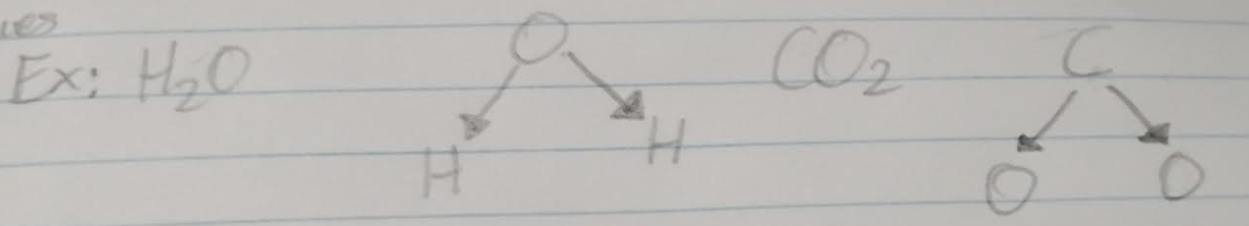
Qu’est-ce qu’une molécule
Une molécule est un regroupement d’au moins deux atomes qui unis par des liens chimiques. Ces atomes peuvent être identiques (élément) ou différent (composé).

Les éléments et le tableau périodique
Les symboles chimiques
Élément: une substance qui est pure (propre type de particules).
Symbole chimique: une façon de représenter un élément.
EX: Hydrogène= H Oxygène= O H2O= une molécule d’eau
Les symboles chimiques sont universels. Ils sont les mêmes dans les toutes les langues.
Les règles pour créer le symbole chimique des éléments
Règle 1. Utilisation de la première lettre du nom de l’élément en majuscule.
EX: Carbon = C
Règle 2. Si la première est déjà utiliser par un autre élément, prendre le 2 premiers du nom (Majuscule suivie par minuscule)
EX: Cuivre = Cu
Règle 3. Si les deux premières lettres sont déjà pris, prendre la première lettre et une autre lettre.
EX: Berkélium = Bk
Les métaux, les non-métaux et les métalloïdes
Les métaux
Un métal est un élément qui possède ces propriétés:
Le lustre
La conductivité
La malléabilité
La ductilité
Les non-métaux
Un non-métal est le plus souvent un gaz ou un solide poudreux et mat.
Les non-métaux sont généralement des mauvais conducteurs de courant, peu de chaleur et d’électricité.
Les métalloïdes
Un métalloïde possède à la fois des propriétés des métaux et des non-métaux.
Dans un tableau périodique, la plupart des éléments sont des métaux, on les retrouve dans la partie gauche, tandis que les éléments non-métalliques sont dans la partie droite. Entre les groupes, on trouve les éléments métalloïdes.

Régularités dans le tableau périodique
Un tableau périodique est composé des éléments classés selon leurs similitudes des propriétés, en lignes horizontales (rangées) et en lignes verticales (colonnes).
Il y a 18 colonnes appelées FAMILLES, dont 8 familles notées (de 1 à 2) et (de 13 à 18). Les 10 familles notées (de 3 à 12) sont des métaux de transition. Et 8 rangées appelées PÉRIODES.
Familles chimiques
Les éléments d’une même colonne forment une famille. Ils ont les propriétés chimiques voisines.
Donc, les éléments du
Famille 1: Métaux alcalins
Famille 2: Alcalins Terreaux
Famille 13: Terreux
Famille 14: Carbonides
Famille 15: Azotides
Famille 16: Sulfurides
Famille 17: Halogènes
Famille 18: Gazes rares
Périodes
Une période est une rangée (ligne horizontale), leur tableau périodique. On dit que tableau périodique (qui régulièrement) car on retrouve les éléments avec les mêmes propriétés à des intervalles réguliers, on trouve donc une colonne, il y a 8 périodes.
Ligne 1 = Période 1
Ligne 2 = Période 2 etc.
Le numéro d’une période est toujours égal au nombre de couches électroniques qu’un atome.
EX: Na L’atome de sodium se trouve dans la période 3, alors qu’il possède trois couches électroniques.
Couche Électronique
Une couche électronique est une zone autour du noyau d’un atome. On note les couches par des lettres (K, L, M, etc.).
Un atome est composé d’un noyau dans lequel on trouve les protons (p+) et les neutrons (n0) et d’électrons (e-) qui se déplacent autour. Ces électrons occupent des zones autour des noyaux (appelées couches électroniques). Ces couches ont pour caractéristiques d’avoir un nombre défini d’électrons.
MODÈLE ATOMIQUE DE RUTHERFORD-BOHR
Numéro atomique et nombre de masse
Dans un tableau périodique, on retrouve les informations suivants:
Z = nombre atomique, c’est le nombre de protons que l’élément contient.
A = le nombre de masse, c’est la masse d’un atome de cet élément.
Le nombre de masse donne aussi du nombre moyen de neutrons que le noyau contient.
X = le nom de l’atome
Un neutron: C’est une particule de charge neutre située dans le noyau de l’atome note n0.
Ainsi, le nombre de neutrons = nombre de masse - nombre atomique
#n0 = A – Z
Modèle Atomique de Rutherford-Ford
Ce modèle a pour but de représenter un atome en indiquant le nombre de ses protons dans le noyau dans le nombre d’électrons qui tournent autour de son noyau dans les couches électroniques.
Pour remplir les couches électroniques avec les électrons, on doit respecter les règles suivantes
La première couche doit contenir au maximum deux électrons (bien remplie)
La deuxième couche doit contenir au maximum 8 électrons (bien remplie) et ceci c’est jusqu’au numéro atomique 20
La dernière couche ne doit pas avoir plus de 8 électrons
On écrit: K(2) L(8) M(8) K = 2é L = 8é M = 8é
EX: l’oxygène possède 8 électrons Sa distribution électronique sera K(2) L(6)
Argon = K(2) L(8) M(8)
Couche de Valence
Déf: la couche de valence est la couche électronique externe dite aussi couche périphérique, donc la dernière couche d’un atome. La couche de valence est la couche électronique M.
Électron de valence
Ils sont les électrons qui se trouvent sur la couche de valence et qui sont susceptibles d'intervenir dans l'établissement des liaisons chimiques entre différents atomes pour former une molécule.
Comment déterminer le nombre d'électrons de valence
Dans le tableau périodique, le nombre le groupe on famille peuvent de connaître le nombre d'électrons de valence. Donc, le nombre d'électrons de valence correspond au nombre de chiffre des unités du nombre de groupe au famille.
Ainsi on a;
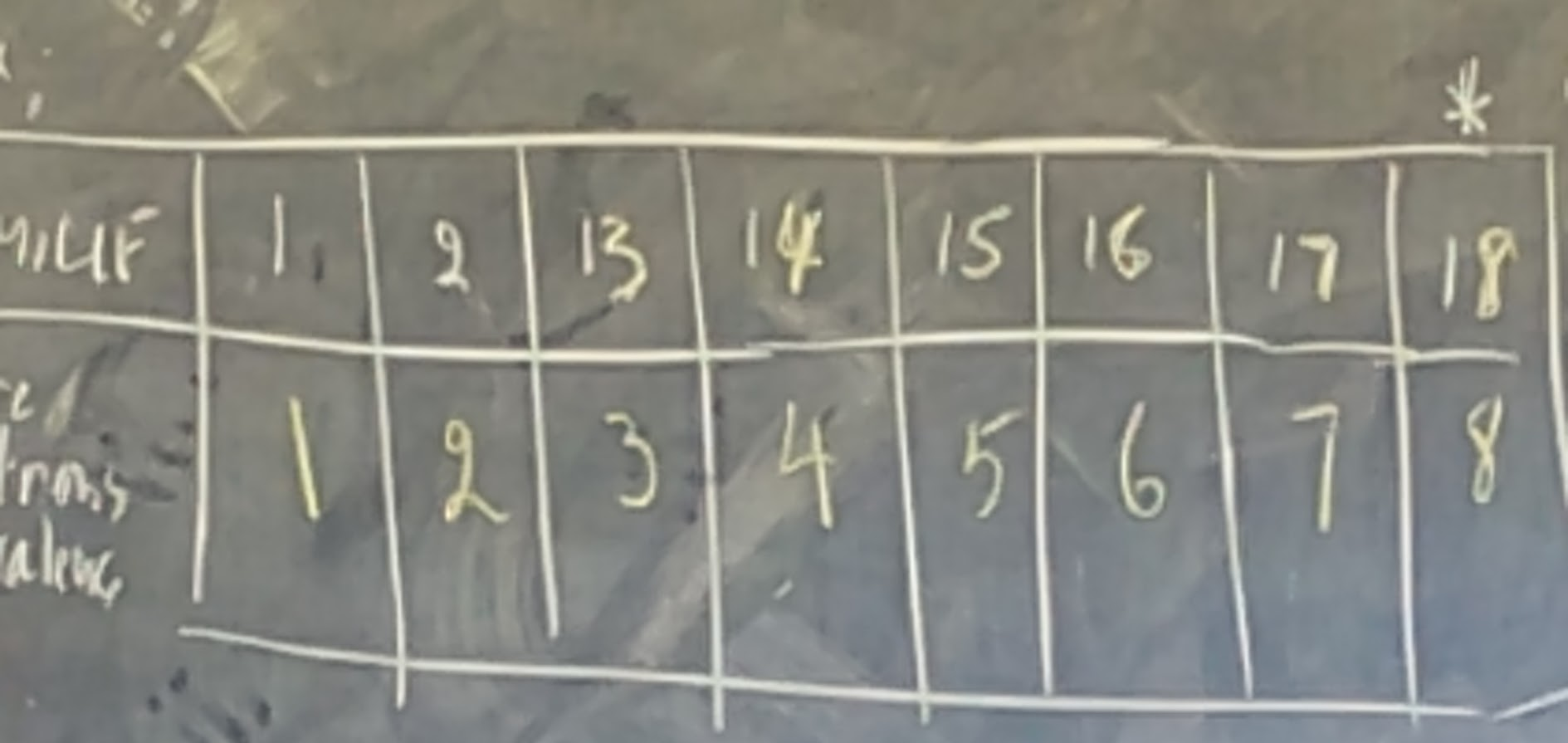
Pour la famille 18; sauf l'hélium qui lui possède que 2 électrons.
La connaissance des électrons de valence d'un atome peuvent de mieux comprendre ou de mieux anticiper les réactions chimiques car, ce sont eux qui interviennent dans les liaisons chimiques.
Le diagramme de Lewis
Le diagramme de Lewis sont à représenter les éléments et leurs électrons de valence. Les éléments de valence sont représentés par les points autour de l'élément.
Liaisons Chimiques
Pourquoi les éléments participent à des réactions chimiques?
Peut-on prédire comment les éléments se lient ensemble pour former des composés chimiques?
Les atomes participent à des réactions chimiques dans le but d’avoir leur couche périphérique ou couche de valence pleine d’électrons.
Lorsque la couche de valence est pleine d'électrons, on dit qu’elle est STABLE.
Pour être stable, l’hydrogène doit avoir 0 ou 2 électrons.
Les éléments du numéro atomique 2 (Hélium) jusqu’à 5 (Bore) doivent avoir 2 électrons sur leur couche de valence pour être stable.
Les éléments de numéro 6 (carbone) jusqu’à 20 (calcium) doivent avoir 8 électrons sur leur couche de valence pour être stable.
Pour avoir une couche pleine d’électrons, les atomes peuvent soit:
Gagner un ou plusieurs électrons provenant d’autres atomes (GAIN D’ÉLECTRONS)
Donner un ou plusieurs électrons à l’autre atome (porte d’électrons)
Partager des électrons avec d’autres atomes
LES ÉLECTRONS DE VALENCE ET LES GROUPES D’ÉLÉMENTS (FAMILLES)
Les métaux alcalins
Les métaux alcalins ont l’électron dans leur couche de valence. Ils doivent donc perdre l’électron pour devenir stable.
Les métaux alcalino-terreux
Les métaux alcalino-terreux ont 2 électrons de valence et ils doivent les perdre pour devenir stable.
Les Halogènes
Les halogènes ont 7 électrons de valence, pour devenir stable ils doivent gagner 1 électrons.
Les gaz rares ou inertes
La couche de valence de valence de gaz inertes est déjà pleine d’électrons. Ils ne peuvent ni gagner ni perdre d’électrons. Donc, les gaz inertes ne participent pas aux réactions chimiques.
Liaisons Chimiques
Déf: Une liaison chimique le transfert ou le partage d’un ou plusieurs électrons entre deux atomes.
La formation d’une liaison chimique entre deux atomes crée un composé plus stable que chacun des atomes pris séparément.
Pour être stable, chaque atome doit chercher à remplir sa couche de valence. À cet effet, certains atomes ont tendance à gagner des électrons supplémentaires et d’autres vont plutôt en (cèdes) on perdre les électrons de valence des atomes que l’on veut lier subissent l’influence de chacun des noyaux impliqués.
RÈGLE D’OCTET
C’est la tendance que les atomes ont d’acquerir la configuration électronique du gaz rare qui est le plus proche dans le tableau périodique.
Quand un élément qui perd des électrons, il devient appelée un ion chargé positivement (Cation).
EX: Écrit comme ça - Al3+
Quand un élément gagne des électrons, il devient un ion chargé négativement (Anion).
EX: Écrit comme ça - F1-
Les métaux deviennent des ions chargés positivement (Cation) An+.
Les non-métaux deviennent des ions chargés négativement (Anion) Bm-.
M = Nombre d’électrons reçus
N = Nombre d’électrons perdus
CATION ET ANION
Lorsqu’un atome perd ou gagne un ou des électrons sans que le nombre de ses protons change, il devient un ION et porte une charge positive ou négative.
CATION: Est un ion à charge positive c’est-à-dire qui a perdu ds électrons pour se stabiliser sans changer le nombre de de ses protons et est noté avec l’exposant positif
EX: Xn+ ou n est le nombre d’électrons perdus
ANION: Est union à charge négatif c’est-à-dire qui a gagné des électrons pour se stabiliser sans changer le nombre de ses protons et est noté avec l’exposant négatif.
EX: Xn- ou n est le nombre d’électrons gagnés
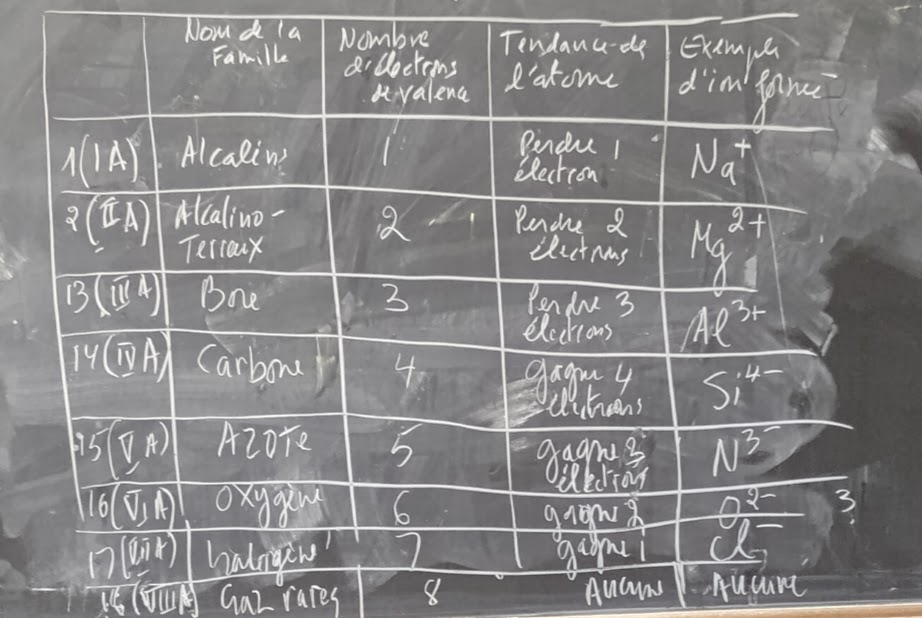
Le tableau résumé des ions formés par les éléments de principales familles du tableau
TYPE DE LIAISONS
Il y a trois types des liaisons chimiques:
Liaisons ioniques
Liaisons covalentes
Liaisons métalliques
Liaison ioniques
Il y a une liaison ionique quand un atome transfert des électrons à un autre atome. Ce type de liaison se fait entre métal et un non-métal.
Cation - Anion (ils s’attirent)
La nomenclature et le règles de nomenclature
La nomenclature permet de nommer les composés chimiques, ce qui permet de reconnaître une molécule qui possède deux éléments.
RÈGLES À SUIVRE
L’atome qui apparaît en deuxième dans la formule moléculaire (non-métal) est nommé en premier dans le nom chimique et on doit y ajouter le suffixe “ure” à la terminaison. Il faut donc lire la molécule à l’envers (de droit à gauche).
On ajoute “de” après avoir nommé l’atome. Ensuite, l’atome qui apparaît en premier dans la formule molécule (métal) est nommé en deuxième dans le nom chimique sans être modifié.
On désigne le nombre d’atomes de chaque élément à l’aide d’un préfixe qu’on ajoute au début du nom des éléments.
Pour connaître le nombre maximale de l’électrons sur chaque couche électronique d’un atome, on utilise la règle suivante
Nombre d’électrons = 2n2 avec n le numéro de la couche élevé au carré puis multiplier par 2
Couche 1: 2(1)2 = 2 électrons K(2)
Couche 2: 2(2)2 = 8 électrons L(8)
Couche 3: 2(3)2 = 18 électrons M(18)
Il existe quelques exceptions à la règle de la nomenclature.
Azote = Nitrure Hydrogène = Hydrure Oxygène = Oxyde Carbone = Carbure Soufre = Sulfure
PRÉFIXES EN FONCTION DE NOMBRE D’ATOMES PRÉSENTS DANS LA MOLÉCULES
1 = Mono 2 = Di 3 = Tri 4 = Tétra 5 = Penta 6 = Hexa 7 = Hepta 8 = Octa 9 = Nona 10 = Déca
On n’utilise pas les préfixes avec une liaison ionique.
Liaison Covalente
Une liaison covalente est une liaison chimique dans laquelle deux atomes se partagent un ou des électrons.
Donc,
LIAISON COVALENTES = PARTAGE DES ÉLECTRONS ENTRE DEUX ATOMES
Dans cette liaison
Les deux atomes sont tous les non-métaux
Les deux atomes peuvent être identiques
Un non-métal peut se lier avec l’hydrogène
Il n’y a pas d’ions
On retrouve les liaisons covalentes dans les composés moléculaires
Exemples
H2 deux atomes d’hydrogène vont se partager un seul l’électrons pour une indice
H2O
MÉTHODE DE CHIASME (pour former des molécules)
Trouver les symboles pour les éléments présents sur le tableau périodique (1er métal, 2e non-métal)
Écrivez les charges ioniques en haut
Échangez-les et écrivez-les en bas (en indices)
SImplifiez si c’est possible
Nomenclature (suite)
COMPOSÉ COVALENT = COMPOSÉ MOLÉCULAIRE
Rappel: Un composé ionique contient un métal et un non-métal. Dans sa nomenclature, on n’utilise pas les préfixes (di, tri, etc…). (TRANSFERT DES ÉLECTRONS)
Composé Covalent ou Moléculaire
Un composé covalent ou moléculaire contient deux non-métaux. (PARTAGE DES ÉLECTRONS). Dans sa nomenclature, on utilise les préfixes (di, tri, etc…).
Exemples:
Al2S3 Il est un composé ionique Al = Aluminium S = Soufre SON NOMENCLATURE: Sulfure d'aluminium
N2O3 N = Azote O = Oxygène Il s’agit de composé covalent ou moléculaire. Alors, on doit utiliser les préfixes 2 azotes = Diazote 5 oxygènes = Pentaoxygène = Pentoxyde Donc N2O5 = Pentoxygène de diazote
Trisulfure = S3
UNIT 3 - ASTRONOMIE
Définition de l’univers
L’univers est l’ensemble de tout ce qui existe, y compris l’énergie, la matière et l’espace.
On s’intéresse à l’espace seulement. Tous les objets qui se trouvent dans l’espace ont CORPS CÉLESTE ou ASTRE.
L’astronomie étudie les corps célestes se trouvent au-delà de la Terre qui sont:
Les étoiles
Les planètes
Les Galaxies
Les astéroïdes
Les nébuleuses
Les trous noirs, etc.
Les Étoiles
Le Soleil: C’est l’étoile la plus proche de la Terre, car il est visible. Une étoile émet de la LUMIÈRE.
Les Planètes
Les Planètes: Une planète est un corps céleste qui tourne autour d’une étoile. Les planètes n’émettent pas de lumière, mais on peut les observer dans le ciel parce qu’elles réfléchissent celle des étoiles.
EX: la Terre, notre planète
Le système solaire comprend le Soleil et tous les objets qui tournent autour de lui qu’on appelle PLANÈTES et qui sont au nombre de huit (8), dont c’est un ensemble de l’espace gouverné par l’attraction (la gravité).
Les Planètes du Système Solaire: Il existe deux types de planètes. Telluriques et les planètes des géantes gazeux. Quatre planètes telluriques dites aussi rocheuses (Puisqu’elles sont proche du Soleil).
Mercure
Vénus
Terre
Mars
Quatre planètes dites GÉANTES GAZEUSES (puisqu’elles sont éloignées du Soleil).Jupiter
Saturne
Uranus
Néptune
Satellite
C’est un corps céleste qui tourne autour de la planète.
EX: la Lune est une satellite naturel de la Terre.
Galaxie
Une galaxie est un énorme regroupement rotatif de gaz de poussière et de milliards d’étoile de planètes et d’autres corps célestes.
EX: LA VOIE LACTÉE est une galaxie ou appartient à la Terre.
Le Soleil et sa Structure
Le Soleil est une sphère de gaz essentiellement constituée d’hydrogène et d’hélium dont la cohésion est maintenue par l’attraction de la gravité.
Il est constitué de quatre différentes couches superposées qui sont:
La couronne
La chromosphère
La photosphère
Le coeur
Distance entre le Soleil et d’autres Planètes
Unités Utilisées en Astronomie
Pour mesurer les distances sur Terre, on utilise souvent le Kilomètre. Cependant, en astronomie, l’unité astronomique est notée UA.
L’unité astronomique (UA) est l’unité de mesure correspondant à la distance moyenne qui sépare la Terre du Soleil, sont environ 150 million de kilomètres environ (exactement 149 597 870 km).
Cette unité est utilisée pour mesurer les distances à l’intérieur de notre système solaire, par exemple, entre les différentes planètes et entre les planètes et le Soleil.
Étant donné qu’une unité astronomique correspond à la distance moyenne entre la Terre et le Soleil alors on considère que 1 UA = 150 millions de km.
Ainsi, la Terre est à l’UA du Soleil, alors que Neptune, par exemple, se trouve environ 30 UA du Soleil.
Aussi, la distance entre la planète Mars et le Soleil est de 1,5 UA. Ce qui signifie qu’elle est 1,5 fois plus grande que la distance entre la Terre et le Soleil.
Jupiter se trouve à environ 778 300 000 km du Soleil. Soit X la distance en UA.
1 UA = 149 599 000 km
1 km = 1 UA / 149 599 000 km
778 300 000 km = 778 300 000 km / 149 599 000 km = 5,2 UA
Mars tourne autour du Soleil à une distance de 1,5 UA
Vitesse de Propagation de la Lumière
Dans l’espace, la vitesse de la lumière est d’environ 300 000 km par seconde.
Vitesse = distance / temps → d = vt
On dit qu’un objet parcourt une distance (d) pendant le temps (t).
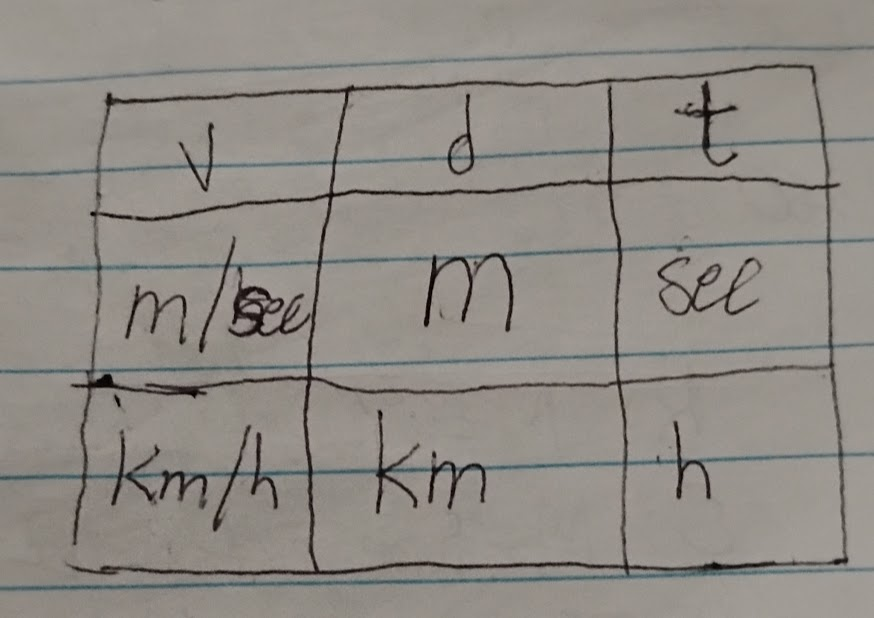
EX: La distance entre la Terre et le Soleil est d’environ 150 millions de km. Calcule le temps mis par la lumière du Soleil pour attendre la Terre.
On a:
t = d / v = 150 000 000 km / 300 000 km/s = 1 500 km / 3 km/s = 500 s
500s / 60 = 8 min 20s
Le temps mis par la lumière pour arriver jusqu’à la Terre est de 8 minutes et 20 secondes.
LA MESURE DES DISTANCES AU-DELÀ DU SYSTÈME SOLAIRE
Au-delà du système solaire, il y a d’autres objets célestes tels:
Les planètes naines
Les satellites
Les astéroïdes et les météorites
Les comites
Pour mesurer la distance des étoiles et d’autres objets situés au-delà du système solaire, on utilise l’unité de mesure de la distance appelé ANNÉE LUMIÈRE (AL) qui correspond à la distance parcourue par la lumière dans l’espace en 1 an.
On a un que dans l’espace la voiture de la lumière est de 300 000 km par seconde. Alors, une AL équivalente à environ 9,46 × 1012 km par sec = 1 AL = 9,46 × 1012 km
EX: calculer la distance d’une étoile en AL. Proxima du Centaure est situé à 4,01×1013 km de la Terre. Comment cette distance s’exprime-t-elle en AL ?
La Vie et la Mort d’une Étoile
Naissance d’une étoile
Une étoile est née au sein d’un nuage de gaz et de poison interstellaire que l’on appelle “NÉBULEUSE”.
Ce gaz est un mélange d’hydrogène (H) et de l’hélium (He). À l’explosion de la nébuleux, il se forme une “PROTOÉTOILE” qui mènerait à la formation d’une étoile.
L’évolution des Étoiles
Les grandes étapes de l’évolution d’une étoile massive se résument en quelques phases clés:
- La supergéante rouge ou bleu
- Étoile de type solaire
- Étoile naine
- Étoile neutron
- le trou noir si sa masse dépasse environ 20 fois celle du soleil
La mort d’une étoile
Il y a deux façons que cela peut se produire, selon le type d’étoile dont il s’agit de:
1. Les Étoiles de Même Type que le Soleil
- Étoile devenue une géante rouge sa masse égale ou inférieure à celle du Soleil
- Étoile devenue supergéante rouge sa masse est 10 fois plus grande que celle du Soleil
-Une naine blanche est une petite étoile chaude et pâle qui constitue le résidu d’une géante rouge
2. Les Étoiles de Plus Grande Masse que le Soleil
Les étoiles plus massives que le Soleil finissent par exploser. C’est le phénomène du “SUPERNOVA” (étoile massive qui s’effondre en NAINE BLANCHE ou ÉTOILE À NEUTRON dans un gigantesque explosion)
Une Explosion Supernova
Est une explosion très lumineuse d’une étoile massive qui se produit à la fin du cycle de sa vie.
En résumé
La séquence reproduit cycle de vie d’une étoile est
Nébuleuse
Protoétoile
Fusion nucléaire (combinaison des noyaux de deux atomes légers pour former un noyau plus lourd) ici c’est l’hydrogène et l’hélium
Supernova
Étoile à neutron
La Théorie de Big-Bang
L’univers est immense, en réalité, il est seulement infini mais il est encore en expansion.
La théorie actuellement admise est celle de BIG-BANG qui explique sa naissance à partir d’un minuscule point appelé PARTICULE DE PLANQUE, il y a environ 13,7 milliards d’années.
Dans cette théorie, on dit qu’une énorme explosion aurait traversé la particule de planque pour créer les premières particules, et les propulsées dans la vie dans le vide en peu de temps.
En se diséminant, ces particules se sont regroupées pour créer des objets de plus en plus complexes. Atomes, étoiles, galaxies, etc.
EN RÉSUMÉ
BIG-BANG + EXPANSION = EXPLOSION ORIGINELLE = CRÉATION DES PREMIÈRES PARTICLES + REGROUPEMENT + ATOMES, ÉTOILES, GALAXIES
L’Exploration Spatiale ou Conquête de l’Espace
À quoi sert l’exploration spatiale?
L’exploration spatiale:
Permet de découvrir et visiter d’autres planètes.
Permet de comprendre et l’enrichir nos connaissances et de trouver les ressources qui améliorent la vie de tout un chacun sur Terre.
Favorise l’entente et la collaboration internationale
Il y a multiple réponses selon votre compréhension
Comment y arriver ?
La lune a déjà été visitée
Mars a déjà reçu des robots qui sondent soin sol
Il reste encore d’autres missions à faire pour visiter d’autres planètes
Quelles sont les contributions du Canada dans ces différentes missions ?
UNIT 4 - ÉLECTRICITÉ
I. DÉFINITION DE L’ÉLECTRICITÉ ET DE LA CHARGE ÉLECTRIQUE
Déf 1: L’électronique est l’ensemble des phénomènes provoqués par des charges positives et négatives qui existent dans l’atome.
Déf 2: LA charge électrique est une propriété des protons et des électrons. Une proton porte une charge positive (+) alors qu’un électrons porte une charge négative (-).
ATOME est électriquement neutre car le nombre des protons est égal au nombre d’électrons.
II. LES FORCES D’ATTRACTION ET DE RÉPULSION
Les charges électriques de même signe se repoussent et les charges électriques de signes contraris s’attirent.
III. TYPES D’ÉLECTRICITÉ
On distingue deux types d’électricité l’ÉLECTRICITÉ STATIQUE et l’ÉLECTRICITÉ DYNAMIQUE.
ÉLECTRIQUE STATIQUE
“STATIQUE = Signifie stationnaire, ce qui ne bouge pas”
Déf: L’électricité statique est un charge électrique stationnaire.
EX: Un choc provoqué en touchant une porte. Ce choc est provoqué par le transfert des électrons d’un premier objet à un deuxième.
ÉLECTRISATION DE LA MATIÈRE (D’OBJET)
Il existe trois manières d’électriser un matière ou un objet ou de lui attribuer une charge. Un objet s’électrise signifie qui il gagne de perd ses charges.
ÉLECTRISATION D’UN OBJET PAR FROTTEMENT
Lorsqu’on frotte deux coups différents l’un contre l’autre l’un arrache des électrons à l’autre. Celui qui a gagné des électrons est chargé négativement et l’autre qui a perdu est alors chargé positivement
LA SÉRIE ÉLECTROSTATIQUE
C’est une liste qui indique comment les objets vont perdre ou gagner des électrons lorsqu’ils entrent en contact entre eux.
ÉLECTRISATION PAR CONTACT (OU PAR CONDUCTION)
Dans cette électrisation, un objet neutre devient chargé électrisé lorsqu’il entre en contact un objet chargé (positivement ou négativement).
ÉLECTRICITÉ DYNAMIQUE
Déf: L’électricité dynamique implique un mouvement des électrons contrôlé dans un conducteur.
Donc, on peut dire tout simplement que ÉLECTRICITÉ DYNAMIQUE = COURANT ÉLECTRIQUE
Courant Électrique: C’est une quantité de charge électrique (électron) qui se déplacent c’est-à-dire qui sautent d’atomes en atomes dans un circuit.
L’électricité dynamique circule facilement dans un conducteur (fils) et difficilement dans un isolant.
Pour faire circuler le courant, il faut un CIRCUIT ÉLECTRIQUE et une SOURCE D’ÉNERGIE qui provoque un grand nombre d’électrons
LES CIRCUITS ÉLECTRIQUES
Déf: Les circuits électriques sont des montages qui permettent la circulation du courant électrique.
COMPOSITION D’UN CIRCUIT ÉLECTRIQUE
Un circuit électrique comporte au moins quatre éléments.
Le générateur: appareil que fournit l’énergie électrique (pile, alternateur, etc.). Il est représenté par son unité de mesure est le VOLT (V)
Le récepteur: appareil qui reçoit l’énergie électrique et la transforme en une autre énergie (tous les appareils électriques). Il est représenté par son unité de mesure est OHMS (Ω).
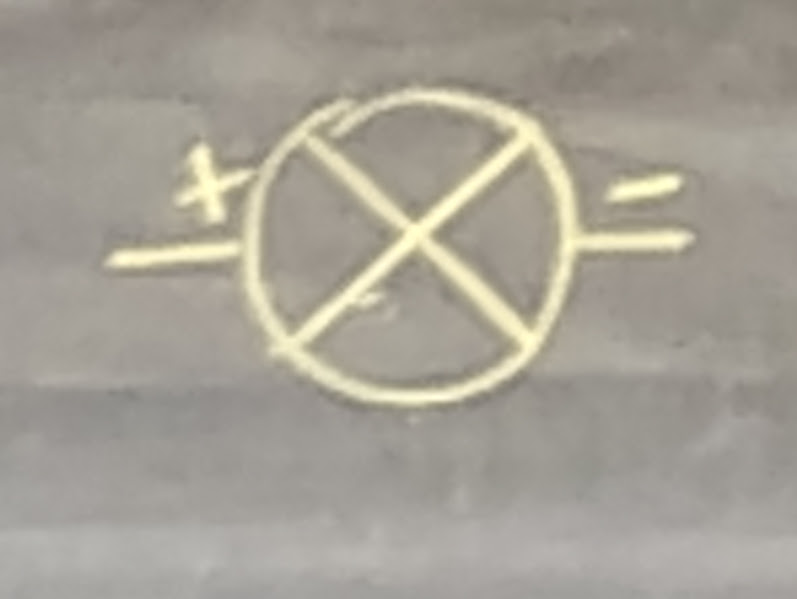
Le conducteur: Élément qui relie électriquement le générateur et le récepteur. Son unité de mesure est Amperes (A).
Le protecteur: Qui doivent interrompre le passage de courant en cas de court-circuit ou de surcharge (fusible, disjoncteur).
Interrupteur: qui sert à allumer ou éteindre.
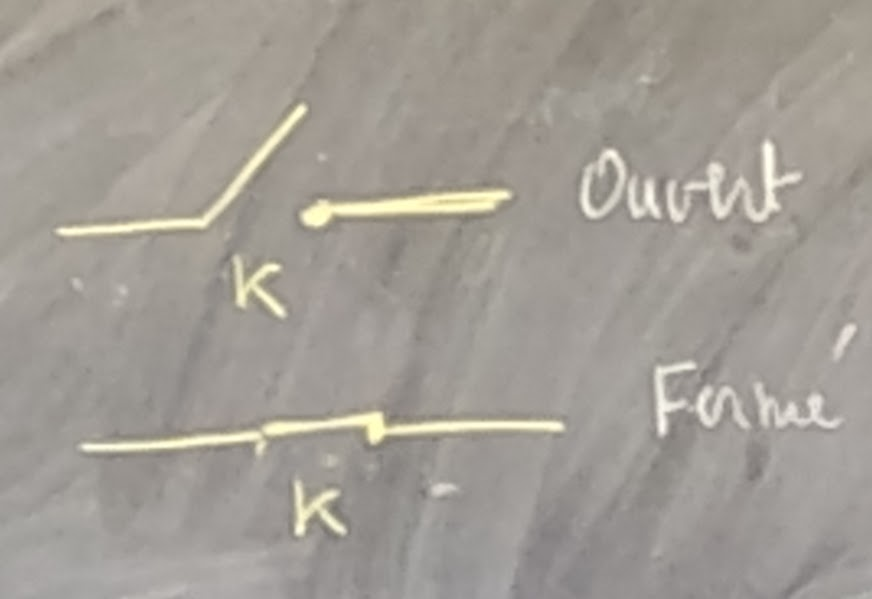
Le courant ne passe pas quand c’est ouvert. Le courant passe quand c’est fermé.

Le générateur: C’est une source d’énergie pour créer une différence de potentiel ou TENSION mesure en Volt
Le récepteur: Élément qui utilise l’énergie et dont la résistance se mesure en OHMS.
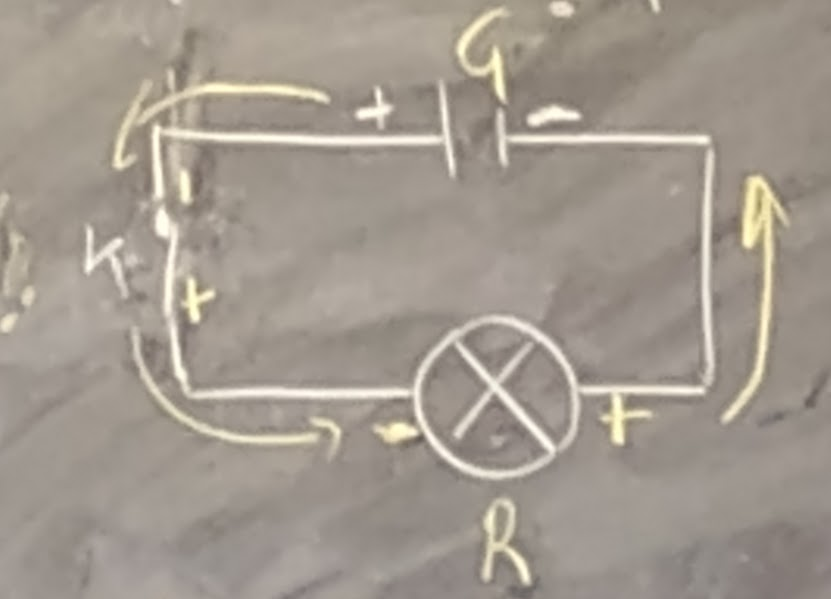
Le générateur et le récepteur sont appelés les DIPÔLES c’est-à-dire fournisseur et récepteur du courant.
CONDUCTEURS ET ISOLANTS
a) Conducteurs sont matériaux que font passer le courant électrique (EX: cuivre, aluminium, etc)
b) Isolants: sont de matériaux qui ne font pas passer le courant électrique (EX: caoutchouc, papier, etc).
DIFFÉRENTS TYPES DE CIRCUITS
Il y a deux types de circuits possibles, CIRCUIT EN SÉRIE et CIRCUIT EN PARALLÈLE
CIRCUIT EN SÉRIE
Un circuit en série est un montage dans lequel les éléments du circuit les uns après les autres. Le courant dans ce circuit n’a qu’un seul chemin possible pour revenir à la source du courant
MONTAGE EN SÉRIE
Des récepteurs sont montés en série, lorsqu’ils sont raccordés but à but, c’est-à-dire, lorsque l’extrémité du premier est raccordé avec le début du deuxième et ainsi de suite (les sorties sont raccordés avec les Entrées).
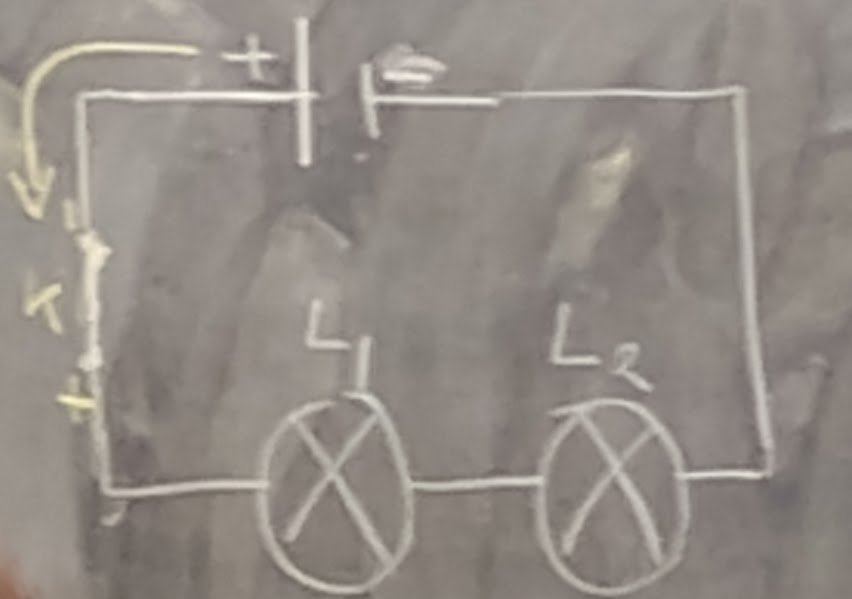
Dans ce circuit, si une lampe s’éteint alors toutes les autres lampes doivent s’éteindre
CHARGE EN SÉRIE
Pour les charges en série, telle que les ampoules s’en ajoute une nouvelle ampoule, la luminosité va diminuer parce qu’il y a seulement un seul trajet ou les électrons circulent.
S’il y a une ampoule de dévisser ou de brûler le circuit sera ouvert parce que les électrons ne peuvent pas circuler.
LES RELATIONS POUR LE CIRCUIT EN SÉRIE
Vt = V1 + V2 + V3 (Différence de potentiel) DDP (Tension) en Volt
Is = I1 + I2 + I3 (Courant) Intensité du courant qui traverse des dipôles en série est la même.
Rt = R1 + R2 + R3 (Résistance) le même courant parcourt les résistances, ce qui veut dire que chacune d’elles fait son travail comme prévu.
LES PILES EN SÉRIE
Pour les piles en série la différence de potentiel de chaque pile est additionnée.
EX: Il y a trois piles en série avec les différences de potentiel suivants Pile 1 = 2V, Pile 2 = 3V, Pile 3 = 6V
DDP = 2V + 3V + 6V
= 11V
AVANTAGE
Un avantage pour les piles en série est qu’il y a augmentation de différence de potentiel.
INCONVÉNIENT
Un inconvénient par les piles en série est que lorsqu’il y a une pile qui est Morten, le circuit ne fonctionne pas.
CIRCUIT EN PARALLÈLE
Un circuit en parallèle est un montage électrique dans lequel les éléments du circuit sont placés parallèlement en unes aux autres. Dans ce circuit, le courant peut revenir à la source par plusieurs chemins différents.
MONTAGE EN PARALLÈLE
Des récepteurs sont montés en parallèles lorsque les deux extrémités de chaque récepteur sont raccordés entre elles du même côte chaque fois (les entrés avec les ENTRÉES et les SORTIES avec les sorties).
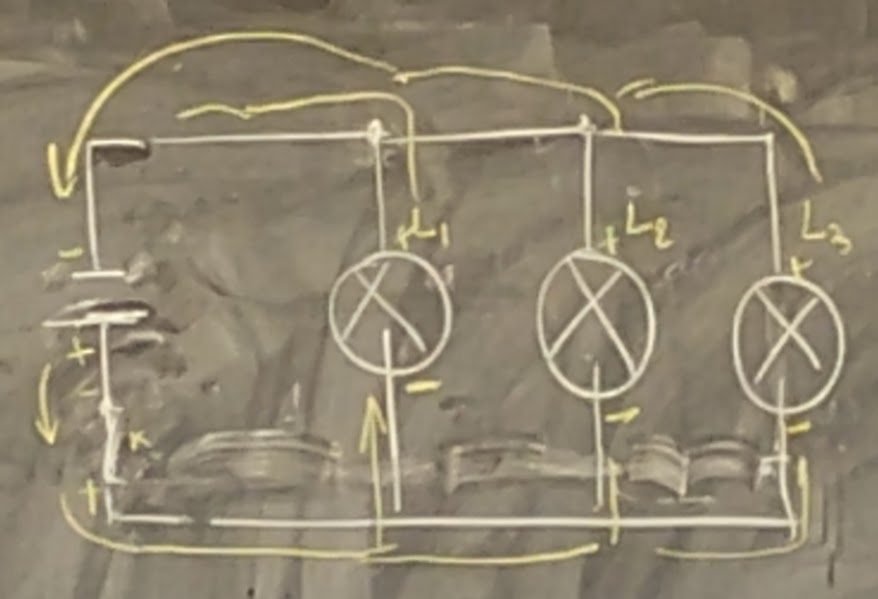
K: L1 ou L2 ou L3 Un interrupteur commandé trois ampoules en parallèle.
CHARGE EN PARALLÈLE
Pour les charges en parallèle, telles que les ampoules. Si on ajoute une autre ampoule, la luminosité ne vas pas charger parce qu’il y a plusieurs trajets ou les électrons circulent. Puisqu’il y a plusieurs trajets dans les circuits en parallèle, n’il y a une ampoule de dévissée ou de brûlée, le circuit va continuer à fonctionner car les électrons peuvent encore circuler.
LES RELATIONS POUR LES CIRCUITS EN PARALLÈLE
Ut = U1 = U2 = U3 (DDP)(TENSION)(VOLT)
Is = I1 + I2 + I3 (Intensité) (A)
1/Req = 1/R1 + 1/R2 + 1/R3 (Résistance)(Ω)
LES PILES EN PARALLÈLE
Pour les piles en parallèle, la différence de potentiel (DDP) (TENSION) est le moyenne des piles.
EX: Il y a trois piles montées en parallèle avec différences de potentiel suivantes.
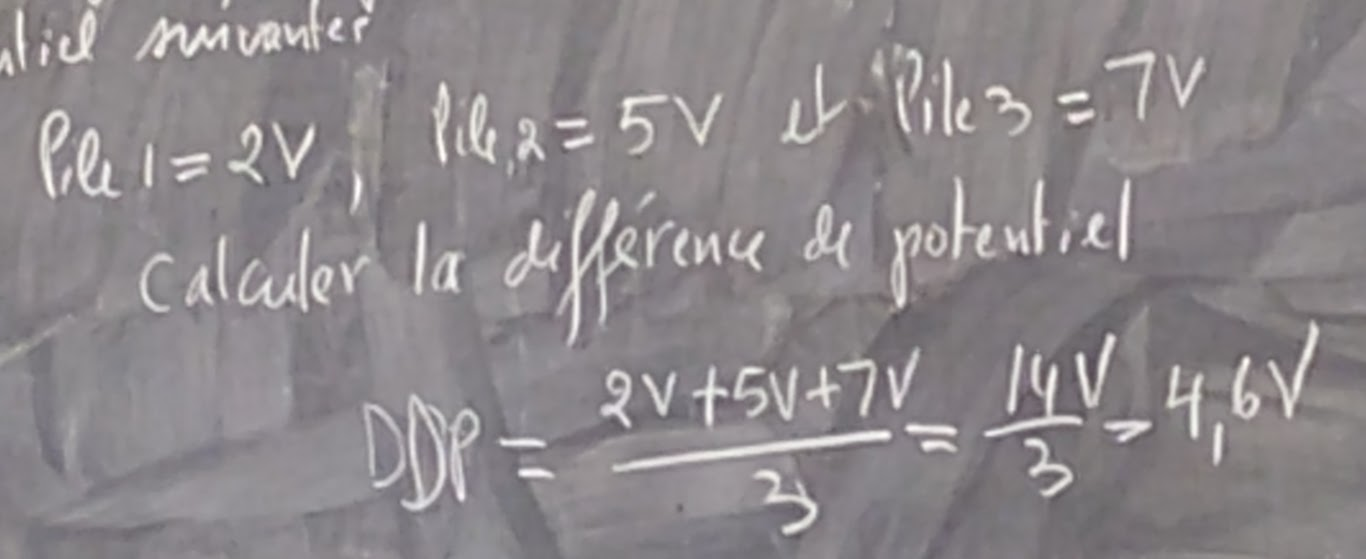
AVANTAGE
Un avantage pour les piles montées en parallèle montées en parallèle est que lorsqu’il y a une pile qui meurt, le circuit continue à fonctionner.
INCONVÉNIENT
Un inconvénient pour les piles montées en parallèles est qu’il n’y a pas augmentation de la différence de potentiel.
LOI D’OHMS
La Loi d’Ohms met en relation trois éléments qui sont:
La valeur d’une résistance en résistance (en ohms)(Ω)
Le courant qui la traverse (en Amperes) (I)
La tension entre ses bornes (en Volts) (U)
U = la tension aux bornes de chaque résistance ou la DDP symbole (V)
I = courant qui traverse la résistance symbole (A)
R = Valeur de la résistance (Ω)
FORMULE
U= R × I qu’on peut exprimer facilement en Volt
V = Ω × A
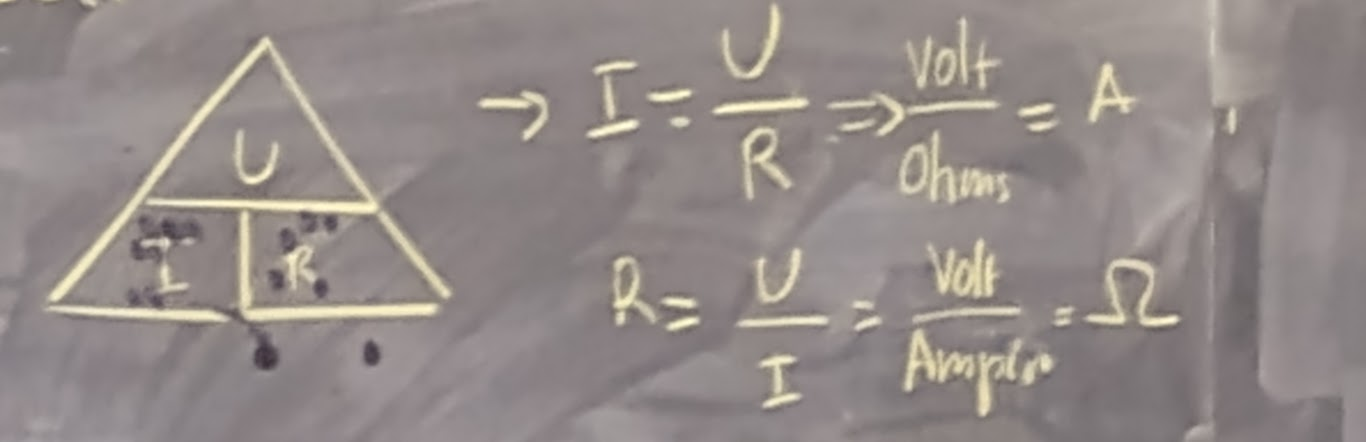
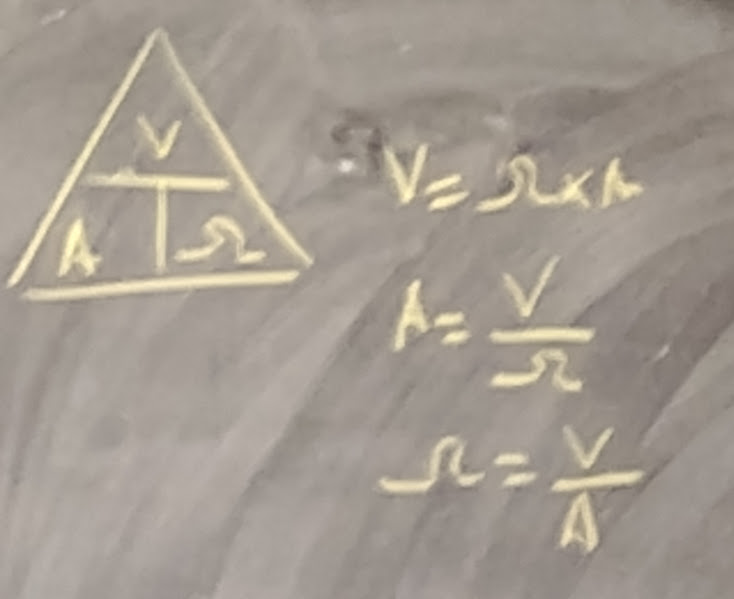
RÉSUMÉ “LOI D’OHMS” (CIRCUITS)

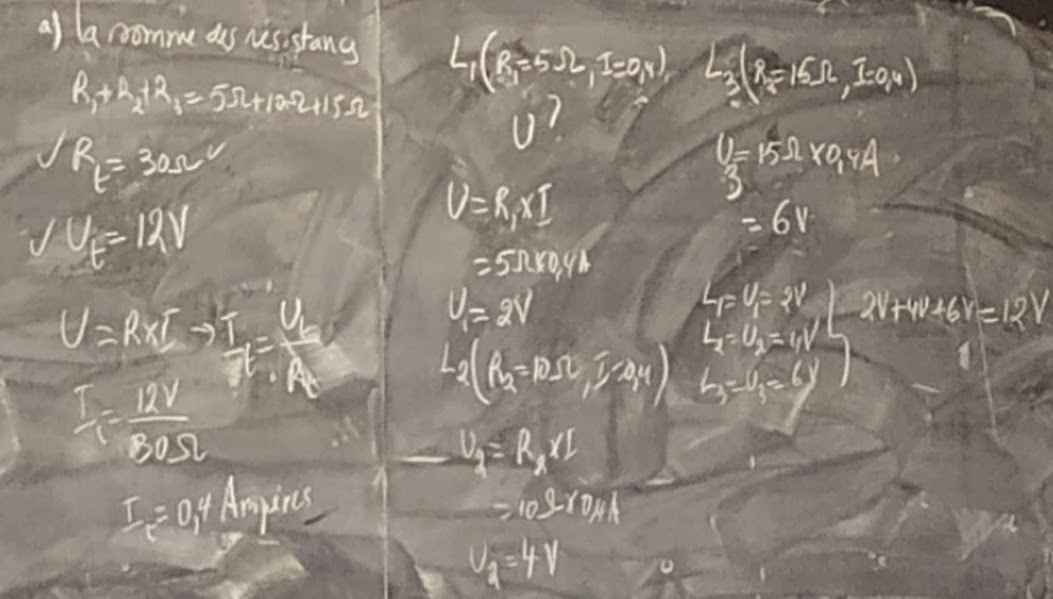
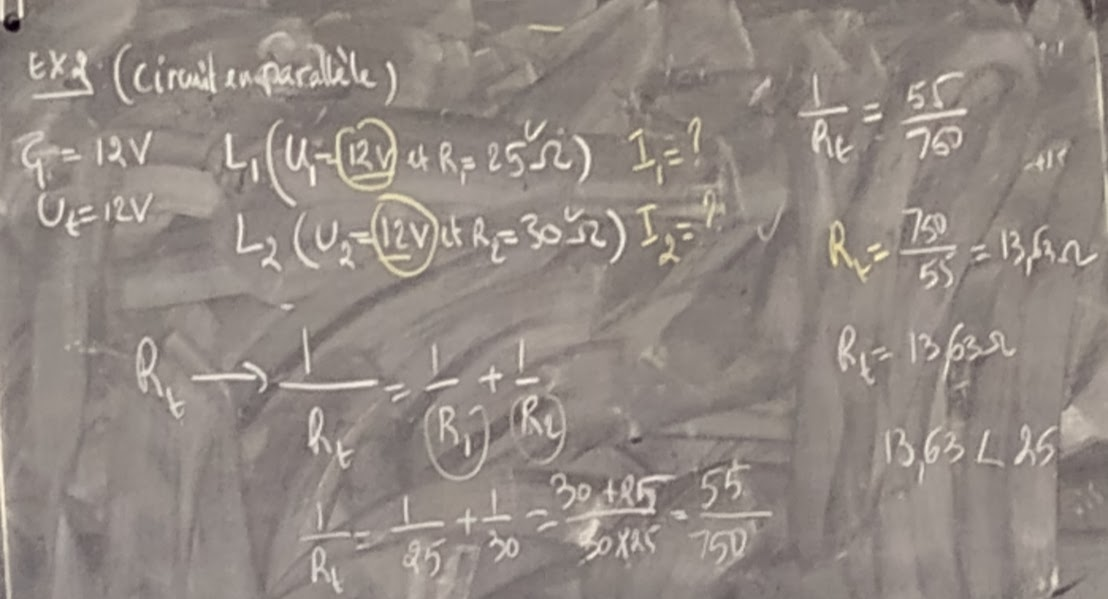
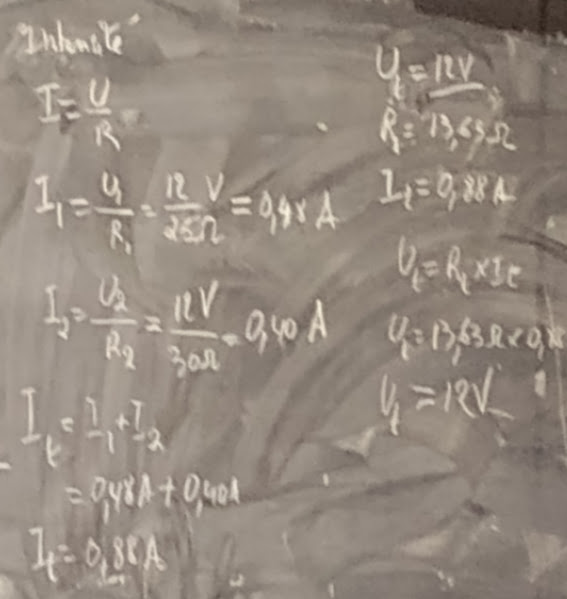
Q: Dans un circuit en parallèle, la tension du générateur est de 2 Volts, les trois récepteurs ont respectivement pour résistances R1 = 2Ω, R2 = 3Ω et R3 = 2Ω
Déterminer les grandeurs manquants, l’intensité et la tension aux bornes de chaque résistance?
Q: Trouver l’intensité dans le circuit en série dont la tension générale est de 2V, les trois récepteurs ont les résistances respectives de 2Ω, 3Ω et 3Ω
ÉNERGIE ÉLECTRIQUE
Tout circuit électrique comporte un générateur qui fournit de l’énergie électrique qui met les charges en mouvement. Donc, l’énergie électrique représente l’énergie sous forme de courant électrique. L’unité de mesure de l’énergie est le JOULE (Symbole J) et son symbole est E.
Les appareils électriques consomment de l’énergie et la transforment en énergie utile et en chaleur.
Par exemple
Un ventilateur transforme l’énergie fourni par le secteur en énergie mécanique et en chaleur (Ça chauffe un peu).
Un grill-pain transforme l’énergie électrique en chaleur. Dans ce cas, la chaleur dissipée et de l’énergie perdue (EFFET JOULE).
On ne peut pas parler de “l’EFFET JOULE“ sans parler de “l’ÉNERGIE ÉLECTRIQUE“.
EFFET JOULE (LA LOI DE JOULE)
EFFET JOULE (LA LOI DE JOULE) est une relation entre le courant électrique traversant une résistance et la chaleur dissipée par celle-ci.
L’effet Joule se manifeste dans tout conducteur, avec plus ou moins d’importance. On voit que la dégagement de chaleur est proportionnel:
À la résistance
Au carré de l’intensité du courant
Au tempo pendant lequel circule le courant
FORMULE: W = R × I2 × t
On mesure aussi la quantité d’énergie en Kilowatt heure mais l’unité légale est la JOULE(J)

L’énergie électrique notée E transférée d’un appareil de puissance nominale P fonctionnement pendant t est par la relation.
La puissance est donc la quantité d’énergie transformé par un appareil en une seconde.
OU ENCORE
La puissance électronique est aussi la vitesse à laquelle l’énergie électrique va être consommé. On peut aussi calculer l’énergie consommé en kilowattheure (Kwh). Pour ce fait, il faut que la puissance soit transformée en kilowatt et les temps en heure.
N.B: Si la quantité d’énergie en Joules a été déjà déterminée l’équivalence suivante peut être
1 Kwh = 3 600 000 J
1 Joule = 1 watt × 1 sec
1h = 60 min = 3 600 sec → 1 sec = 1/3 600 h
1 Kw = 1000 w → 1 watt = 1/1 000 Kw
Donc
1J = 1/1 000 Kw × 1/3 600 h
1J = 1/3 600 000 Kwh = 2,77 × 10-7 Kwh
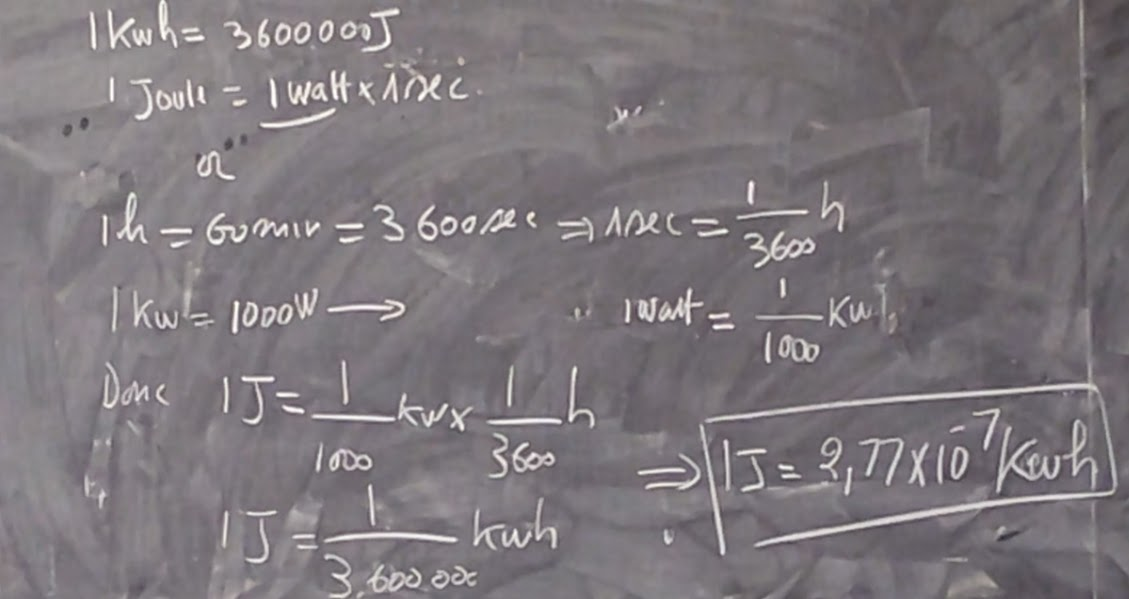
EX: Un appareil d’une capacité de 2 500W, fonctionne pendant 36 minutes. Quelle d’énergie électrique va-t-il consommé?
P = 2 500W Δt = 36 minutes = 2160 sec
E = ? = P × Δt = 2 500W × 2160 sec = 5 400 000 J
EFFICACITÉ D’UN APPAREIL ÉLECTRIQUE
Déf: “L’efficacité d’un appareil est la relation entre l’énergie produite par l’appareil et l’énergie fournie à cet appareil"
CALCUL DE L’EFFICACITÉ D’UN APPAREIL
Pourcentage d’efficacité = (Extrant énergétique / Intrant énergétique) × 100
Extrant Énergétique: C’est la quantité d’énergie produite par l’appareil (PRODUCTION)
Intrant Énergétique: C’est la quantité d’énergie consommé par l’appareil (CONSOMMATION)
EX: Une ampoule produit 35J d’énergie lumineuse, il lui faut 100J d’énergie électrique.
Production = 35J = Extrant
Consommation = 100J = Intrant
La pourcentage de l’efficacité = (35 J / 100 J) × 100
= 35%
CONSOMMATION ÉLECTRIQUE (COÛT DE L’ÉLECTRICITÉ)
Le prix de la consommation électrique dans les facteurs d’électricité est lié de manière proportionnelle à l’énergie consommé. Il est le produit de l’énergie électrique consommé par le prix d’un Kilowattheure.
D’ou
Pour calculer le coût d’utilisation d’un appareil électrique il faut connaître sa puissance et son tempo d’utilisation afin de déterminer la quantité d’énergie consommée par l’appareil.
Formule de Calcul
Coût d’utilisation = Électricité consommé × temps d’utilisation × coût de l’électricité
EX: Une ampoule incandescente de 100W est utilisée pour éclairer l’extérieure d’une maison a) Si elle reste allumée 8 heures par nuit, combien aura coûté son utilisation au bout d’un a ? le coût de l’énergie électrique est de 0.07$ / Kwh.
b) Quelle aurait été l’économie d’argent si on avait remplacé l’ampoule incandescente par un tube fluorescent de 13W.
 Knowt
Knowt