Redoxreacties H1
soorten anorganische reacties
ionuitwisselingsreacties
oxidatiegetal veradnert niet
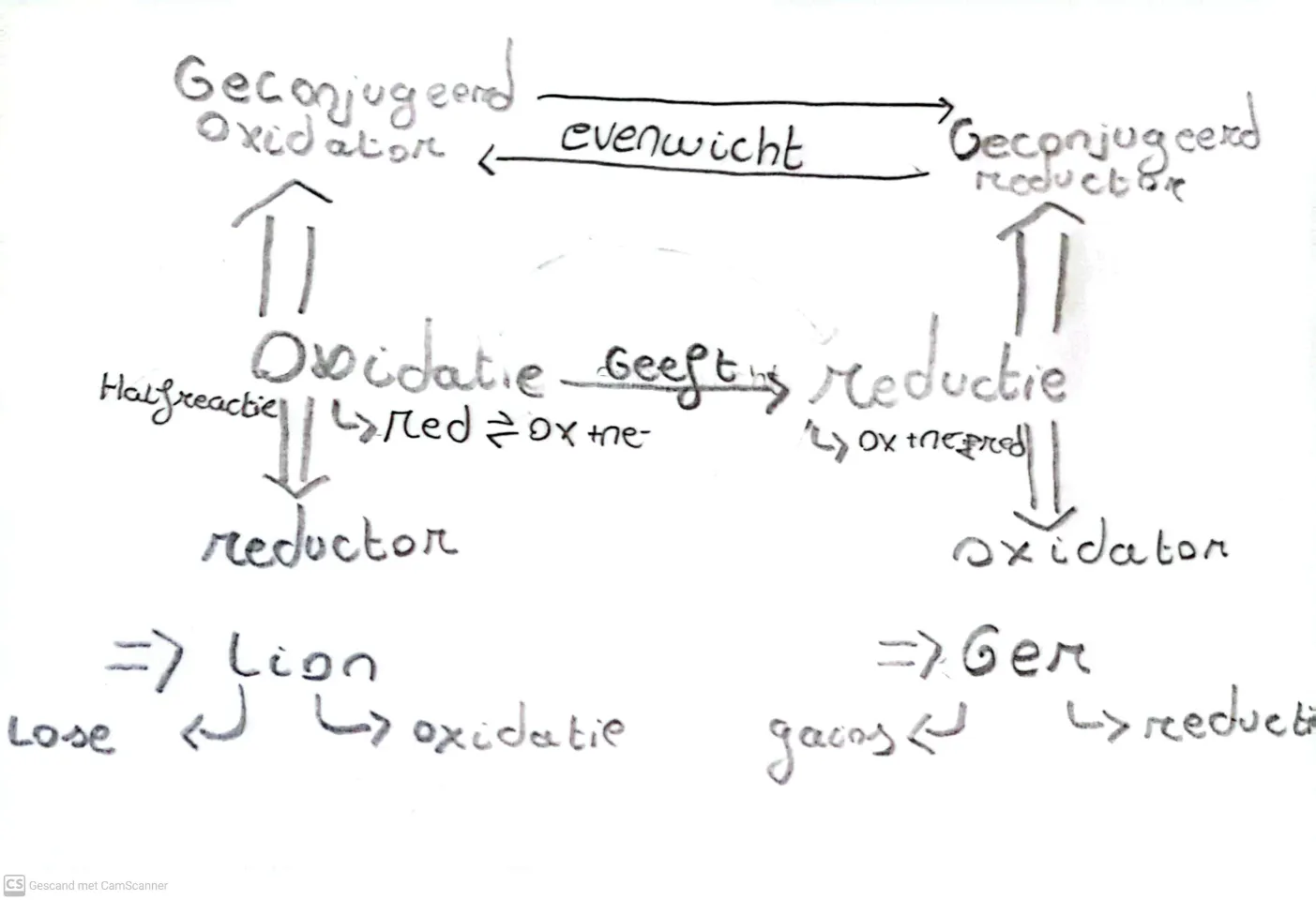
elektronoverdrachtreacties
oxidatiegetal veradnert door oxidatie en reductie
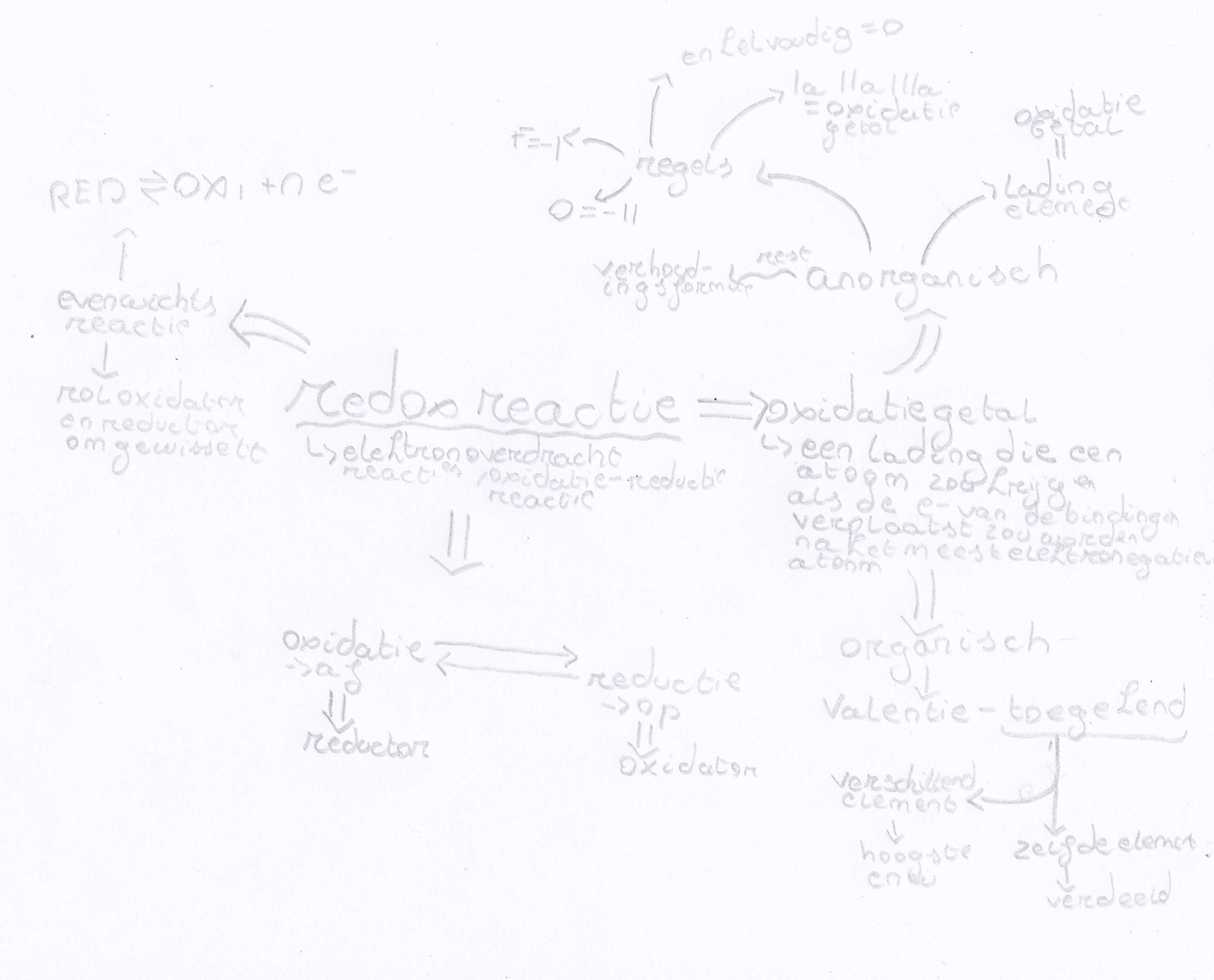
oxidatiegetal
lading die het atoom zou krijgen als de e- van de bindingen verplaats zouden worden na het meest elektronegatieve atoom.
anorganisch
in een ionbinding, dus een binding tussen metaal en niet metaal elementen. Bij deze binding worden electronen overgedragen en krijgt elk element een lading, die lading is gelijk aan de oxidatiegetal.
regels
De groepen Ia, IIa en IIIa zijn hetzlfde als de oxidaitegetall.
Enkelvoudige atomen hun oxidatiegetal = 0,
O = -2, F = -1.
Voor de rest doe je de verhoudingsformule.
organisch
Valentie elektronen - Toegekende electronen = OxidatieGetall
verschillende atomen = toegend gaat naar grootst
Zelfde atomen = Toegekend gaat naar allebij verdeeld
Redoxreacties
uitzondeirngen
H₂O₂ (waterstofperoxide)
OG van O = –1
(Normaal is O –2)NaH (natriumhydride)
OG van H = –1
(Normaal is H +1)F₂O (difluorideoxide)
OG van O = +2
(Omdat F altijd –1 is)O₃ (ozon)
OG gemiddeld = 0, maar de bindingen zijn anders verdeeld.