Toepassingen van redoxreacties
verbranding
Koolwatertsof komt in contact met zuurstof en gaat oxideren. Hier komt energie vrij wat gerbuikt kan worden voor brandstof, verwarming.
toepassingen
aardgas of methaan word gebruikt in keukens om dingen te koken
bezine of diesel wordt gerbuikt om motoren vrooom te laten doen :D
formule
je moet gwn eig balanceren
_STOF + _O2 <=> _CO2 + _H2O
CKFS en pfas
Dit zijn sterke fluor koolstof verbindingen die hittebesdendig zijn.
toepassingen
blusdekens of schuimblussers
anti-baklagen
Roesten
ijzer komt in contact met water of zuurstof waardoor het langzaam aan begint te roesten. Je kan een process bekend als galvanisatie gebruiken om een ander metaal rond ijzer te zetten zodat die beschermd word. (Fe2O3 → Fe)
formule
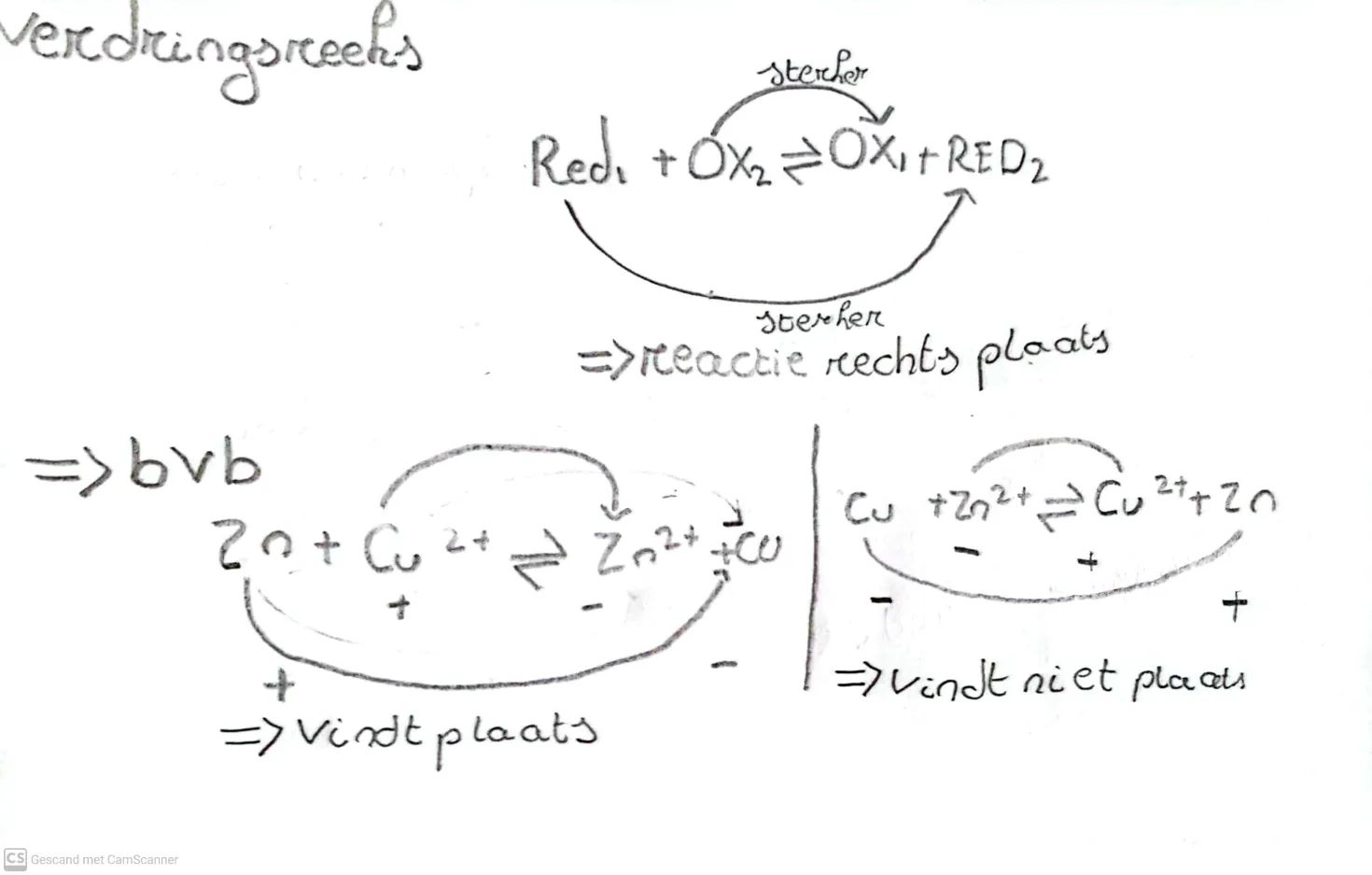
gwn uit elkar zoals Zn + Cu 2+ → Zn 2+ + Cu
Galvanische reactie
Galvanische processen worden ook gebruikt voor stroom of batterijen. omdat een sterke oxidator / reductor elektronen op / afgeeft aan een zwakke oxidator / reductor komen de ladingen in beweging zodat je energie krijgt.
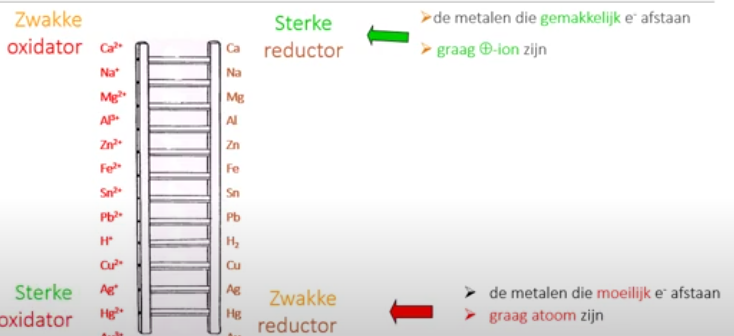
Verdringsreeks
Dit process komt van de verdringsreeks van metalen. Dit geeft aan hoe makkelijk een metaal elektronen afgeeft. Een sterk zuur geeft altijd af aan een zwak zuur, Andersom kan niet. Dit is experimenteel bepaald en in een chemische ladder gezet.
Chemische ladder
H2O zit ook in de ladder maar is eerder een referentie punt. Zit het onder H2O dan is het een sterke reductor en is er een reacite. Zit het boven water dan is een een zwakke en is er een moeilijekere reactie. onder H is edel en boven zijn ondelde
Je hebt ook een verdringsreeks voor niet metalen dat precies hetzelfde werkt.